
| A、c(NH4+)+c(H+)═c(Cl-)+c(OH-) |
| B、当c1=c2时,c(NH4+)+c(NH3?H2O)═c(Cl-) |
| C、当pH=7,一定是C2>C1 |
| D、当pH<7,一定是C1=C2 |


科目:高中化学 来源: 题型:
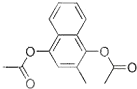 维生素k4是核酸的组成成分,在体内参与RNA和DNA合成.可用来治疗肿瘤病人因化疗或放疗等引起的白细胞减少.下列有关维生素k4说法正确的是
维生素k4是核酸的组成成分,在体内参与RNA和DNA合成.可用来治疗肿瘤病人因化疗或放疗等引起的白细胞减少.下列有关维生素k4说法正确的是| A、③④⑥ | B、①②③ |
| C、②⑤⑥ | D、④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、与W相邻的同主族元素可制成重要的半导体材料 |
| B、元素原子半径从大到小的顺序是X、Y、Z |
| C、W、Y、Z元素最高价氧化物对应的水化物中酸性最强的是H2YO4 |
| D、X的单质在W的最高价氧化物中的燃烧反应属于置换反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、使苯酚显紫色的溶液:NH4+、K+、SCN-、NO3- |
| B、澄清透明的溶液:Cu2+、Mg2+、SO42-、Cl- |
| C、0.1mol?L-1 Na2CO3溶液:NH4+、Fe2+、SO42-、NO3- |
| D、c(Fe2+)=1.0 mol?L-1溶液:H+、K+、Cl-、MnO4- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、少量浓硫酸沾在皮肤上,立即用氢氧化钠溶液冲洗 |
| B、若实验室发生漏电着火时,应用大量水灭火 |
| C、实验后,剩余的药品不能放回原瓶,应放在指定位置 |
| D、含硫酸的废液倒入水槽,用水冲入下水道 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| PH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
| A、CO2+H2O+2NaClO═Na2CO3+2HClO |
| B、2HCN+Na2CO3═CO2+2NaCN+H2O |
| C、常温下电离常数比较:Ka (H2CO3)>Ka(CH3COOH)>Ka(C6H5OH) |
| D、结合质子能力由强到弱的顺序为:CO2-3>HCO-3>CH3COO- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com