
����Ŀ���������ȼҵ�еķ�������Ҫ�ɷ���þ�Ĺ����κ�̼���Σ����������������Ƶ��Σ���ʵ����������Ϊԭ����ȡMgSO47H2O��ʵ��������£� 29.0g���� ![]()
![]() ��Һ�����Һ�����Ʒ
��Һ�����Һ�����Ʒ
��֪����������Ksp[Mg��OH��2]=6.0��10��12 �� ������Һ�У�Fe2+��Fe3+��Al3+�ӿ�ʼ������������ȫ��pH��Χ����Ϊ7.1��9.6��2.0��3.7��3.1��4.7�������ֻ�������ܽ�ȣ�S�����¶ȱ仯��������ͼ��ʾ��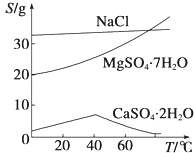
��1���������м���ϡ�����pHΪ1��2�Լ���е�Ŀ������
��2���������µ���Һ��Mg2+��Ũ��Ϊ6.0molL��1 �� ����ҺpH���ſ��ܲ���Mg��OH��2������
��3������Һ����Һ�����ȼ���NaClO����ҺpHԼΪ5���ٳ��ȹ��ˣ�����ȹ��˵�Ŀ���� �� ��������Ҫ�ɷ�����
��4������Һ���л��MgSO47H2O�����ʵ�鲽������Ϊ������Һ���м����� �ڹ��ˣ��ó���������������Ũ�������½ᾧ���ݹ��ˡ�ϴ�ӵò�Ʒ��
��5������õ�MgSO47H2O������Ϊ24.6g�����������þ[��Mg��OH��2��]�İٷֺ���ԼΪ��MgSO47H2O����Է�������Ϊ246����
���𰸡�
��1��Ϊ�����Mg2+�Ľ�ȡ��
��2��8
��3���¶Ƚϸ�ʱ������þ�η���ø����������CaSO4?2H2O�ܽ��С��Al��OH��3��Fe��OH��3��CaSO4?2H2O
��4��NaOH��Һ��������м�����ϡ����
��5��20.0%
����������1������������ȫ������pHֵ����֪�����������м���ϡ�����pHΪ1��2����е�Ŀ����Ϊ�����Mg2+�Ľ�ȡ�ʣ� ���Դ��ǣ�Ϊ�����Mg2+�Ľ�ȡ�ʣ���2��������þ��Ksp=c��Mg2+��c��OH����2 �� ��Һ��Mg2+��Ũ��Ϊ6.0molL��1 �� ����Һ��c��OH����= ![]() =10��6mol/L������������Ũ��Ϊ10��8mol/L��pHΪ8�����Դ��ǣ�8����3���¶Ƚϸ�ʱ������þ�η���ø����ף����߸������ֻ�������ܽ�ȣ�S�����¶ȱ仯�����ߣ�����֪��������CaSO42H2O�ܽ��С�����õ���������Ҫ�ɷ��ǣ�Al��OH��3��Fe��OH��3��CaSO42H2O��
=10��6mol/L������������Ũ��Ϊ10��8mol/L��pHΪ8�����Դ��ǣ�8����3���¶Ƚϸ�ʱ������þ�η���ø����ף����߸������ֻ�������ܽ�ȣ�S�����¶ȱ仯�����ߣ�����֪��������CaSO42H2O�ܽ��С�����õ���������Ҫ�ɷ��ǣ�Al��OH��3��Fe��OH��3��CaSO42H2O��
���Դ��ǣ��¶Ƚϸ�ʱ������þ�η���ø����������CaSO42H2O�ܽ��С�ȣ�Al��OH��3��Fe��OH��3��CaSO42H2O����4��þ���ӿ��Ժ��������Ʒ�����Ӧ����������þ���������ˣ��õ������ij������ټ������ᣬ�����ᾧ���Ի������þ���壬
���Դ��ǣ�NaOH��Һ��������м�����ϡ�����5����������к�Mg��OH��2������ΪX��MgSO47H2O����Ϊ24.6�ˣ����ʵ�����0.1mol���ɹ�ϵʽMgSO47H2O��Mg��OH��2��֪��Mg��OH��2������Ϊ0.1mol��58g/mol=5.8g���ʸ������к�Mg��OH��2�İٷֺ���Ϊ ![]() ��100%=20.0%��
��100%=20.0%��
���Դ��ǣ�20.0%��


 ��ʦ������Ԫ��ĩ���100��ϵ�д�
��ʦ������Ԫ��ĩ���100��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����m A+n Bp C�ķ�Ӧ�У�m��n��pΪ�����ʵļ��������ֲ��Cÿ��������a mol/L��Bÿ���Ӽ���1.5a mol/L��Aÿ���Ӽ���0.5a mol/L����m��n��pΪ��������
A.2��3��2
B.2��3��3
C.1��3��2
D.3��1��2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������CO2����ͨ��NaOH��Ca��OH��2��NaAlO2�Ļ����Һ�С���֪NaAlO2��CO2��Ӧ����Al��OH��3���������ɳ��������ʵ�����ͨ��CO2������Ĺ�ϵ�ɱ�ʾΪ��������
A.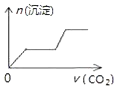
B.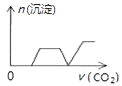
C.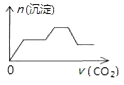
D.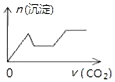
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ�����������������
A. ���ڿ�����ȼ�գ���������ɫ����
B. ��������̼ͨ��ˮ�У�����������
C. ������ͭ˿�ھƾ��ƻ��������գ�ͭ˿������
D. һ����̼ͨ�����ȵ�����������ɫ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ȥ���������л��е����ʣ���ѡ�õ��Լ���������������ȷ����
���� | ���� | ������Ӧѡ�õ��Լ��Ͳ������� | |
A | CO2 | CO | ͨ��O2����ȼ |
B | NaOH���� | Na2CO3���� | ����������ᣬ���� |
C | Cu(NO3)2��Һ | AgNO3��Һ | ���������ͭ�ۣ����� |
D | KNO3��Һ | KOH��Һ | ����������CuSO4��Һ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Ũ�Ⱦ�Ϊ0.1molL��1��������Һ����Na2CO3����NaHCO3����HCl
��1����Һ���а����ʵ���Ũ���ɴ�С˳�����и���Һ�и�����Ũ����
��2����Һ���У�c��CO32����+c��HCO3����+c��H2CO3��= molL��1��
��3����10mL��Һ�ۼ�ˮϡ����100mL�����ʱ��Һ����ˮ�������c�� H+��=molL��1 ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��BF3��һ������ˮ�γɾ���Q[��H2O��2BF3]��Q��һ�������¿�ת��ΪR�� 
��1������Q�и�����������������漰������ĸ����
a�����Ӽ� b�����ۼ� c����λ��
d�������� e����� f�����»���
��2��R�������ӵĿռ乹��Ϊ �� �����ӵ�����ԭ�ӹ�������ӻ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ�NA��ʾ�����ӵ�������ֵ���� ��
A.26g��Ȳ�������õ��Ӷ���ĿΪ3NA
B.��״���£�11.2L���ȼ��������ķ�����Ϊ0.5NA
C.һ�������£�2.6g��Ȳ�����ͱ���ϩ����̬�����������̼ԭ����Ϊ0.2NA
D.1mol����10NA������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й�����ϩ�������˵���У�����ȷ����(����)
A.��ϩ���ڲ������������������ڱ�������
B.��ϩ����������ԭ�Ӵ���ͬһƽ���ϣ����������Ϊ����ṹ������ԭ�Ӳ���ͬһƽ����
C.��ϩ�����е�  ����������е�̼̼������Ƚϣ�˫���ļ��ܴ�����
����������е�̼̼������Ƚϣ�˫���ļ��ܴ�����
D.��ϩ��ʹ����KMnO4��Һ��ɫ�����鲻��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com