
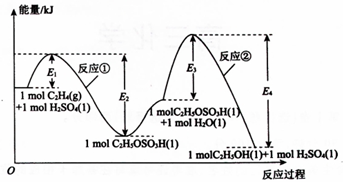
 乙烯间接水合法合成乙醇分两步完成,反应过程中的能量变化如图所示,对于在密闭容器中进行的合成反应,下列说法不正确的是( )
乙烯间接水合法合成乙醇分两步完成,反应过程中的能量变化如图所示,对于在密闭容器中进行的合成反应,下列说法不正确的是( )| A. | H2SO4是乙烯间接水合法合成乙醇的催化剂 | |
| B. | 缩小容器容积,乙烯的转化率增大 | |
| C. | 反应①和反应②均为放热反应 | |
| D. | 反应②的反应热△H=-(E3-E4)kJ•mol-1 |
分析 由图象信息知,乙烯间接水合法合成乙醇分两步完成,反应分别为
C2H4(g)+H2SO4(l)=C2H5OSO4H(l)△H=-(E2-E1)kJ•mol-1
C2H5OSO4H(l)+H2O(l)=C2H5OH(l)+H2SO4(l)△H=-(E3-E4)kJ•mol-1
解答 解:由图象信息知,乙烯间接水合法合成乙醇分两步完成,反应分别为
C2H4(g)+H2SO4(l)=C2H5OSO4H(l)△H=-(E2-E1)kJ•mol-1
C2H5OSO4H(l)+H2O(l)=C2H5OH(l)+H2SO4(l)△H=-(E4-E3)kJ•mol-1,
A.H2SO4是乙烯间接水合法合成乙醇的催化剂,故A正确;
B.缩小容器容积,相当于增加浓度,平衡正向移动,故乙烯的转化率增大,故B正确;
C.由以上分析得,反应①和反应②均为放热反应,故C正确;
D.反应②的反应热△H=-(E4-E3)kJ•mol-1,故D错误,
故选D.
点评 依据图象正确书写出乙烯间接水合法合成乙醇的方程式是本题解题的关键,本题难度中等.


科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ④⑥ | C. | ③⑥ | D. | ③⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 海水淡化的方法有蒸馏法、离子交换法、电渗析法等 | |
| B. | 明矾水解时能生成具有吸附性的胶体粒子,故可用于消毒杀菌 | |
| C. | Ba2+对人体无毒,故BaSO4在医学上可用作“钡餐” | |
| D. | 与铜质水龙头连接处的铜质水管不易发生腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
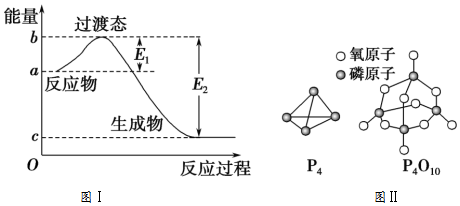
| 化学键 | P-P | P-O | O═O | P═O |
| 键能/(kJ/mol) | a | b | c | x |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
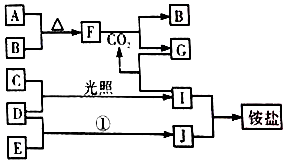 如图是部分短周期元素的单质及其化合物(或其溶液)的转化关系,已知B、C、D、E是非金单质,且在常温常压下都是气体;化合物G的焰色反应为黄色,化合物I和J通常状况下呈气态;反应①是化工生产中的一种重要固氮反应
如图是部分短周期元素的单质及其化合物(或其溶液)的转化关系,已知B、C、D、E是非金单质,且在常温常压下都是气体;化合物G的焰色反应为黄色,化合物I和J通常状况下呈气态;反应①是化工生产中的一种重要固氮反应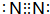 ,F
,F ;
; ;
;查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
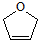 是一种有机烯醚,可由链烃A通过下列路线制得,下列说法正确的是( )
是一种有机烯醚,可由链烃A通过下列路线制得,下列说法正确的是( )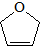
| A. | B中含有的官能团有溴原子、碳碳双键 | |
| B. | A的结构简式是CH2═CHCH2CH3 | |
| C. | 该有机烯醚不能发生加聚反应 | |
| D. | ①②③的反应类型分别为加成反应、取代反应、消去反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学电池可将电能转变为化学能 | |
| B. | 化学反应一定伴随着能量变化 | |
| C. | 燃料燃烧能将化学能转变为热能 | |
| D. | 植物的光合作用将太阳能转化为化学能 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com