
【题目】某混合溶液中可能含有下列离子中的若干种:K+、Na+、Fe2+、Fe3+、SO![]() 、I-、CO
、I-、CO![]() ,现取三份20 mL该溶液进行如下实验:
,现取三份20 mL该溶液进行如下实验:
①第一份加入足量盐酸,无任何气体产生
②第二份加入足量NaOH溶液,经搅拌、过滤、洗涤、灼烧,最后得到x g固体
③第三份滴加0.10 mol·L-1酸性KMnO4溶液,恰好完全反应,消耗其体积为V mL
④另用洁净的铂丝蘸取该混合溶液置于浅色火焰上灼烧,发现火焰呈现黄色
根据上述实验,以下说法正确的是
A. 由实验②、③可判定原混合溶液中是否存在I-
B. 由实验①可推断原混合溶液中是否含有SO![]()
C. 由实验③可判定原混合溶液中是否含有Fe2+
D. 原混合溶液中只存在Na+、Fe3+、SO![]() ,不可能存在K+、CO
,不可能存在K+、CO![]()
【答案】A
【解析】①第一份加入足量盐酸,无任何气体产生,说明溶液中不含CO32-离子,Fe3+和I-不能同时存在;②第二份加入足量NaOH溶液生成沉淀,说明溶液中含有Fe2+或Fe3+离子,或二者都有,根据最后得到xg固体,为氧化铁,可知总共含有的铁元素的物质的量为![]() ×2=
×2=![]() mol;③第三份滴加0.10molL-1酸性KMnO4溶液,消耗其体积为VmL,说明溶液中含有还原性离子,含有Fe2+离子或I-中的一种或2种,KMnO4的物质的量为V×10-4mol,根据得失电子守恒,Fe2+离子或I-的物质的量之和为5V×10-4mol;④另用洁净的铂丝蘸取该混合溶液置于浅色火焰上灼烧,发现火焰呈现黄色,说明含有Na+离子,但不能确定是否含有K+离子,须通过蓝色钴玻璃观察判断。A. 碘离子和亚铁离子与高锰酸根反应的比例是相同的,高锰酸根折算成亚铁离子,若折算后亚铁离子的物质的量不大于
mol;③第三份滴加0.10molL-1酸性KMnO4溶液,消耗其体积为VmL,说明溶液中含有还原性离子,含有Fe2+离子或I-中的一种或2种,KMnO4的物质的量为V×10-4mol,根据得失电子守恒,Fe2+离子或I-的物质的量之和为5V×10-4mol;④另用洁净的铂丝蘸取该混合溶液置于浅色火焰上灼烧,发现火焰呈现黄色,说明含有Na+离子,但不能确定是否含有K+离子,须通过蓝色钴玻璃观察判断。A. 碘离子和亚铁离子与高锰酸根反应的比例是相同的,高锰酸根折算成亚铁离子,若折算后亚铁离子的物质的量不大于![]() mol,即5V×10-4mol≤
mol,即5V×10-4mol≤![]() mol,说明溶液中含有铁离子,则没有碘离子,若折算后亚铁离子的物质的量大于
mol,说明溶液中含有铁离子,则没有碘离子,若折算后亚铁离子的物质的量大于![]() mol,即5V×10-4mol>
mol,即5V×10-4mol>![]() mol,说明溶液中没有铁离子,则含有碘离子,因此由实验②、③可判定原混合溶液中是否存在I-,故A正确;B. 根据实验①无法推断原混合溶液中是否含有SO
mol,说明溶液中没有铁离子,则含有碘离子,因此由实验②、③可判定原混合溶液中是否存在I-,故A正确;B. 根据实验①无法推断原混合溶液中是否含有SO![]() ,故B错误;C. 根据实验③无法判定原混合溶液中是否含有Fe2+,只能判断含有Fe2+离子或I-中的一种或2种,故C错误;D. 根据上述分析,无法判断原混合溶液中是否存在K+,故D错误;故选A。
,故B错误;C. 根据实验③无法判定原混合溶液中是否含有Fe2+,只能判断含有Fe2+离子或I-中的一种或2种,故C错误;D. 根据上述分析,无法判断原混合溶液中是否存在K+,故D错误;故选A。


科目:高中化学 来源: 题型:
【题目】已知在25 ℃时,醋酸、次氯酸、碳酸和亚硫酸的电离平衡常数分别为
醋酸 K=1.75×10-5 次氯酸 K=2.95×10-8
碳酸 K1=4.0×10-7 K2=5.0×10-11
亚硫酸 K1=1.54×10-2 K2=1.02×10-7
(1)常温下,写出碳酸的第一级电离平衡常数表达式K1=__________,则0.50mol/L的Na2CO3溶液的pH=________
(2)等浓度的Na2CO3和NaHCO3的混合溶液中各离子浓度大小顺序为_____________。
(3)向0.01molL-1CH3COONa溶液中分别加入少量浓盐酸、Na2CO3固体使水解平衡移动的方向分别为___________、________.(填“左”“右”或“不移动”)
(4)物质的量浓度均为0.1 mol/L的CH3COONa和CH3COOH溶液等体积混合混合液中的下列关系式正确的是________。
A.c(CH3COOH)+2c(OH-)=c(CH3COO-)+2c(H+)
B.c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
C.c(CH3COO-)+c(CH3COOH)=0.2mol/L
D. c(CH3COOH) > c(Na+) > c(CH3COO-) > c(H+) > c(OH-)
(5)下列离子方程式中错误的是________。
A.少量CO2通入次氯酸钠溶液中:CO2+H2O+ClO-===HCO![]() +HClO
+HClO
B.少量SO2通入次氯酸钙溶液中:2ClO-+SO2+H2O===SO32-+2HClO
C.Na2CO3溶液中加入足量NaHSO3溶液: CO32-+HSO3-=HCO3-+SO32-
D.少量CO2通入亚硫酸钠溶液中: SO32-+CO2+H2O=HSO3-+HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是( )
A.向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O![]() Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
B.用小苏打治疗胃酸过多:HCO3-+H+= CO2↑+H2O
C.实验室用浓盐酸与MnO2反应制Cl2:MnO2+2H++2Cl-![]() Cl2↑+Mn2++H2O
Cl2↑+Mn2++H2O
D.用FeCl3溶液腐蚀印刷电路板:Fe3++Cu = Fe2++Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组设想将少量Cl2通入Fe2+和I-的混合溶液中,探究Fe2+和I-的还原性强弱。
[提出假设] 假设1:Fe2+还原性比I-强。
假设2:I-还原性比Fe2+强。
[验证假设] 选择几种装置进行实验:

(1)实验必需的装置是A→____________(按Cl2气流方向的顺序填写)。
(2)实验开始后,控制通入氯气的量,当通入少量氯气时,通过观察混合溶液颜色的变化________(填“能”或“不能”)判断反应的先后顺序。
(3)请在下表中写出实验步骤及预期现象和结论________、________、________、________、_______、________。

(4)为了实验成功,必须控制各物质的量。该小组称取1.52g FeSO4固体,同时称取1.66g KI固体,溶于水中配成混合溶液。为了验证上述假设,通入的Cl2体积最多不能超过________L(标准状况)。
[思考与交流]
(5)有同学质疑,上述实验中Cl2量很难控制,无法验证Fe2+和I-反应的先后顺序。于是提出另一方案:往KI溶液中滴入________溶液,如果能发生反应,即可证明I-的还原性强于Fe2+。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列措施不能加快锌粒与1 molL-1H2SO4反应产生H2的速率的是
A. 用锌粉代替锌粒B. 加少量醋酸钠固体
C. 加少量CuSO4固体D. 改用2 molL-1H2SO4与锌粒反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1) 相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1 mol·L-1盐酸、③0.1 mol·L-1氯化镁溶液、④0.1 mol·L-1硝酸银溶液中,c(Ag+)由大到小的顺序为:_________。
(2) 含有Cr2O![]() 的废水毒性较大,某工厂废水中含5.0×10-3 mol·L-1的Cr2O
的废水毒性较大,某工厂废水中含5.0×10-3 mol·L-1的Cr2O![]() 。为了使废水的排放达标,进行如下处理:Cr2O
。为了使废水的排放达标,进行如下处理:Cr2O![]()
![]() Cr3+、Fe3+
Cr3+、Fe3+![]() Cr(OH3)、Fe(OH)3
Cr(OH3)、Fe(OH)3
(a) 该废水中加入绿矾和H+,发生反应的离子方程式为__________________。
(b) 若处理后的废水中残留的c(Fe3+)=2.0×10-13 mol·L-1,则残留的Cr3+的浓度为_____
(已知:Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=6.0×10-31)。
(3)某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。请回答下列问题:
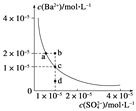
(a) 下列说法正确的是________(填序号)。
A.向BaSO4饱和溶液中加入固体Na2SO4可以由a点变到b点
B.通过蒸发可以由d点变到c点
C.d点无BaSO4沉淀生成
D.a点对应的Ksp大于c点对应的Ksp
(b) 将100 mL 1 mol·L-1 H2SO4溶液加入100 mL含Ba2+ 0.137 g的溶液中充分反应后,过滤,滤液中残留的Ba2+的物质的量浓度约为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.如图所示,甲、乙之间的隔板K和活塞F都可左右移动,甲中充入2molA和1molB,乙中充入2molC和1molHe,此时K停在0处。在一定条件下发生可逆反应:2A(g)+B(g)![]() 2C(g);反应达到平衡后,再恢复至原温度。回答下列问题:
2C(g);反应达到平衡后,再恢复至原温度。回答下列问题:
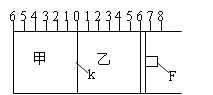
(1)可根据 _______________现象来判断甲乙都已达到平衡状态。
(2)达到平衡时,隔板K最终停留在0刻度左侧a处,则a的取值范围是___________________。
(3)若达到平衡时,隔板K最终停留在左侧刻度1处,此时甲容积为2L,反应化学平衡常数为______________(带单位)
Ⅱ.若一开始就将K、F如图固定,其他条件均不变,则达到平衡时:
(1)测得甲中A的转化率为b,则乙中C的转化率为 _________________ ;
(2)假设乙、甲两容器中的压强比用d表示,则d的取值范围是 ____________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计如下微型实验装置用以验证SO2的性质,通过分析实验,下列结论表达不正确的是( )
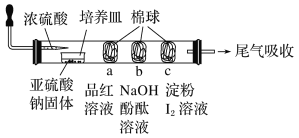
A. a棉球褪色,验证SO2具有漂白性
B. b棉球褪色,验证SO2具有酸性氧化物的性质
C. c棉球蓝色褪去,验证SO2具有还原性
D. 只能用烧碱溶液吸收尾气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com