
| 时间/min | 0 | 10 | 20 | 40 | 50 | |
| T1 | n(CH4)/mol | 1.00 | 0.70 | 0.50 | 0.20 | 0.20 |
| T2 | n(CH4)/mol | 1.00 | 0.60 | 0.36 | … | 0.30 |
| A. | T2时NO2的平衡转化率为70.0% | |
| B. | 该反应的△H<0、T1<T2 | |
| C. | 保持其他条件不变,T1时向平衡体系中再充入1.00molCH4和2.40molNO2,与原平衡相比,达新平衡时N2的浓度增大、体积分数减小 | |
| D. | 保持其他条件不变,T1时向平衡体系中再充入0.60molCH4和1.60molH2O(g),平衡向正反应方向移动 |
分析 由表中数据可知,T1温度在40min到达平衡,开始对应各组分浓度相等,前20min内温度T2的反应速率大于温度T1的,则温度T2>T1,T2温度先到达平衡,到达平衡时间小于40min,50min处于平衡状态,此时甲烷的物质的量为0.30mol,大于T1温度平衡时的0.2mol,说明平衡逆向移动,则正反应为放热反应,
A.计算平衡时参加反应的甲烷物质的量,进而计算转化率;
B.根据分析可知,正反应为放热反应;
C.再充入1.00molCH4和2.40molNO2,平衡正向移动,氮气浓度增大,等效为在原平衡基础增大压强,与原平衡相比平衡逆向移动;
D.根据K=$\frac{c({N}_{2})•c(C{O}_{2})•{c}^{2}({H}_{2}O)}{c(C{H}_{4})•{c}^{2}(N{O}_{2})}$判断浓度商与平衡常数相对大小,若Qc=K,处于平衡状态,若Qc<K,反应向正反应进行,若Qc>K,反应向逆反应进行.
解答 解:由表中数据可知,T1温度在40min到达平衡,开始对应各组分浓度相等,前20min内温度T2的反应速率大于温度T1的,则温度T2>T1,T2温度先到达平衡,到达平衡时间小于40min,50min处于平衡状态,此时甲烷的物质的量为0.30mol,大于T1温度平衡时的0.2mol,说明平衡逆向移动,则正反应为放热反应,
A.T2平衡时参加反应的甲烷物质的量:1mol-0.30mol=0.70mol,甲烷的平衡转化率为:$\frac{0.70mol}{1.0mol}$×100%=70%,故A正确;
B.根据分析可知,温度T1<T2,该反应的正反应为放热反应,则其△H<0,故B正确;
C.再充入1.00molCH4和2.40molNO2,平衡正向移动,氮气浓度增大,等效为在原平衡基础增大压强,与原平衡相比平衡逆向移动,达新平衡时N2的体积分数减小,故C正确;
D.保持其他条件不变,T1时向平衡体系中再充入0.60molCH4和1.60molH2O(g),此时甲烷浓度为0.8mol/L,原平衡时生成的水为(1.0-0.2)mol×2=1.6mol,此时水的浓度为3.2mol/L,其它物质浓度不变,根据K=$\frac{c({N}_{2})•c(C{O}_{2})•{c}^{2}({H}_{2}O)}{c(C{H}_{4})•{c}^{2}(N{O}_{2})}$可知此时的浓度商Qc>K,则反应向逆反应进行,故D错误;
故选D.
点评 本题考查化学平衡计算与影响因素、化学反应速率影响因素,关键是根据甲烷物质的量变化判断温度大小,侧重考查学生对数据的分析处理能力,注意根据浓度商与平衡常数关系判断反应进行方向.


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:选择题
| A. | 石英只能用于生产玻璃 | |
| B. | 从海水提取物质不一定要通过化学反应才能实现 | |
| C. | 二氧化硅能与氢氧化钠溶液反应,故常用氢氧化钠溶液作为雕刻玻璃的试剂 | |
| D. | 为了提高土壤肥力,往往将碳铵与熟石灰混合使用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1:1 | B. | 2:2:1 | C. | 1:3:2 | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大 | |
| B. | 对某一达到化学平衡状态的反应,若外界条件使反应速率改变,平衡一定会移动 | |
| C. | 在电解精炼铜的过程中,电解液中c(Cu2+)减小 | |
| D. | 500℃、30 MPa下,将0.5 mol N2(g)和1.5 mol H2(g)置于密闭容器中充分反应生成NH3(g)放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ•mol-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
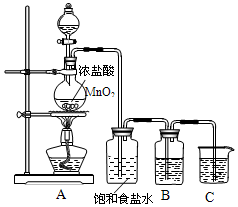 实验室制取氯气的装置如图:
实验室制取氯气的装置如图:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1 pH=7.82 的 NH4HCO3 溶液中:c(HCO3-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | 0.1 mol•L-1 Na2S溶液中:c(OH-)=c(H+)+c(HS-)+2c(H2S) | |
| C. | 浓度均为 0.1 mol•L-1的NH3•H2O 溶液和 NH4Cl 溶液等体积混合:c(NH4+)+c(H+)>c(NH3•H2O)+c(OH-) | |
| D. | 0.1 mol•L-1 Na2S 溶液与 0.1 mol•L-1 NaHS 溶液等体积混合:2c(Na+)-3c(S2-)=3c(HS-)+3c(H2S) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | W | |
| n(起始状态)/mol | 2 | 1 | 0 |
| n(平衡状态)/mol | 1 | 0.5 | 1.5 |
| A. | 此反应的平衡常数表达式是K=$\frac{{c}^{2}(X)•c(Y)}{{c}^{3}(W)}$ | |
| B. | 达到平衡后,升高温度,W的体积分数减少,则此反应的△H>0 | |
| C. | 达到平衡后,增大压强,正、逆反应速率均增大,平衡向正反应方向移动 | |
| D. | 达到平衡后,将容器体积压缩为2L,W的物质的量浓度变为0.75mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com