
| A. | 某烷烃CnH2n+2的一个分子中,含有共价键的数目是3n+1 | |
| B. | 用HNO3酸化的AgNO3溶液检验CCl4中是否含有氯元素 | |
| C. | 红热的铜丝可以和乙醇发生置换反应产生氢气 | |
| D. | 石油化工得到的产品均为液体,煤化工得到的产品有液体也有固体 |
分析 A、烷烃是饱和链烃,烷烃的通式为CnH2n+2,碳原子间以单键连接,碳原子形成四个化学键,即碳氢单键、碳碳单键的数目和;
B、用HNO3酸化的AgNO3溶液,可检验氯离子,但是四氯化碳中不含有氯离子;
C、红热的铜丝可以和乙醇发生氧化反应生成乙醛;
D、石油产品、煤的化工产品均有气体、液体等.
解答 解:A、依据烷烃是饱和链烃,碳原子间以单键连接,碳原子形成四个化学键分析判断,烷烃的通式是:CnH2n+2,含有碳碳单键数为n-1,含有碳氢单键数为2n+2,所以形成共价键数目为n-1+2n+2=3n+1,故A正确;
B、四氯化碳中的氯元素不是氯离子,故此方法错误,故B错误;
C、红热的铜丝可以和乙醇发生氧化反应生成乙醛,不会发生置换反应生成氢气,故C错误;
D、石油产品、煤的化工产品均有气体、液体等,如含烃类物质中有气体、液体等,故D错误,故选A.
点评 本题考查较综合,涉及有机物的结构与性质、有机物反应类型、组成和性质等,综合性较强,注重基础知识的考查,选项C为解答的易错点,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H |
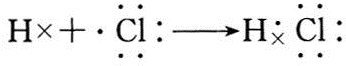 ;B与G形成离子化合物(填“离子”或“共价”),用电子式表示它的形成过程
;B与G形成离子化合物(填“离子”或“共价”),用电子式表示它的形成过程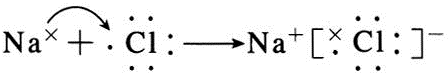 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,很多不饱和有机物在E催化下可与H2发生加成反应:如①乙烯、②H乙炔、③苯、④甲醛.其中碳原子采取sp2杂化的分子有①③④(填物质序号),HCHO分子的立体结构为平面三角形,它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是加成产物CH3OH分子之间能形成氢键(须指明加成产物是何物质)
,很多不饱和有机物在E催化下可与H2发生加成反应:如①乙烯、②H乙炔、③苯、④甲醛.其中碳原子采取sp2杂化的分子有①③④(填物质序号),HCHO分子的立体结构为平面三角形,它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是加成产物CH3OH分子之间能形成氢键(须指明加成产物是何物质)
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 DCH3COOOH
DCH3COOOH .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H+) | B. | c(HCO${\;}_{3}^{-}$) | ||
| C. | c(H+)•c(OH-) | D. | $\frac{c(O{H}^{-})•c(HC{{O}_{3}}^{-})}{c(C{{O}_{3}}^{2-})}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 新型能源氢能的关键技术是储氢.如图装置可实现有机物的电化学储氢(忽略其它有机物),储氢装置的电流效率η=生成目标产物消耗的电子数/转移的电子总数×100%,则下列说法正确的是( )
新型能源氢能的关键技术是储氢.如图装置可实现有机物的电化学储氢(忽略其它有机物),储氢装置的电流效率η=生成目标产物消耗的电子数/转移的电子总数×100%,则下列说法正确的是( )| A. | 该储氢装置的电流效率η=64.3% | |
| B. | D电极室发生的所有的电极反应为:C4H6+6H++6e-═C6H12 | |
| C. | B电极为电源的负极 | |
| D. | H+由D电极室移向E电极室 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y,Z形成的分子空间构型可能是正四面体 | |
| B. | W,Y,Z的电负性大小顺序一定是Z>Y>W | |
| C. | WY2分子中δ键与π键的数目之比是2:1 | |
| D. | W,X,Y,Z的原子半径大小顺序可能是W>X>Y>Z |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com