
| A. | 食盐溶液 | B. | 氯化钙溶液 | C. | 苏打水 | D. | 饱和氯水 |
科目:高中化学 来源: 题型:选择题
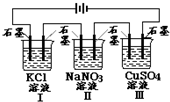 如图装置电解一段时间,当某极析出0.32g Cu时,I、Ⅱ、Ⅲ中溶液pH分别为(溶液足量,体积均为100mL且电解前后溶液体积变化忽略不计)( )
如图装置电解一段时间,当某极析出0.32g Cu时,I、Ⅱ、Ⅲ中溶液pH分别为(溶液足量,体积均为100mL且电解前后溶液体积变化忽略不计)( )| A. | 12、7、2 | B. | 13、7、1 | C. | 1、7、13 | D. | 7、13、1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
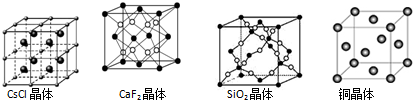
| A. | 在CsCl晶体中,距Cs+最近的Cl-有6个 | |
| B. | 在CaF2晶体中,Ca2+周围距离最近的F-有4个 | |
| C. | 在SiO2晶体中,每个晶胞中含有4个Si原子和8个O原子 | |
| D. | 在铜晶体中,每个铜原子周围距离最近的铜原子有12个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑥ | B. | ①⑤ | C. | ②③④ | D. | ①⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
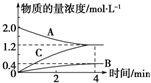 如图,曲线表示在800℃时和某反应有关的物质A、B、C的物质的量浓度从开始反应至4min时的变化图象,试回答:
如图,曲线表示在800℃时和某反应有关的物质A、B、C的物质的量浓度从开始反应至4min时的变化图象,试回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
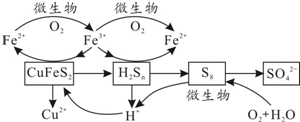
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com