
【题目】100 mL由氯化镁和氯化铝组成的混合液中c (Mg2+)为0.3 mol L-1,c (Cl-)为1.2 mol L-1。要使Mg2+全部转化为沉淀分离出来,则需加入1 mol L-1 NaOH溶液的体积不可能为
A.120 mLB.145 mLC.160 mLD.180 mL
【答案】A
【解析】
因为100 mL由氯化镁和氯化铝组成的混合液中c (Mg2+)为0.3 mol L-1,c (Cl-)为1.2 mol L-1,所以n(Cl-)=1.2 mol L-1×0.1L=0.12mol,n(Mg2+)=0.3 mol L-1×0.1L=0.03mol,溶液中存在电荷守恒:2n(Mg2+)+3n(Al3+)=n(Cl-)可知,n(Al3+)=![]() =0.02mol ,由Mg2+~2NaOH得:Mg2+消耗的NaOH的物质的量=0.03mol×2=0.06mol,由Al3+~4OH-~4NaOH得:Al3+完全转换为AlO2-消耗的NaOH的物质的量=0.02mol×4=0.08mol,所以使Mg2+转换为沉淀完全分离出来消耗NaOH的物质的量最少值=0.06mol+0.08mol=0.14mol,体积为V=
=0.02mol ,由Mg2+~2NaOH得:Mg2+消耗的NaOH的物质的量=0.03mol×2=0.06mol,由Al3+~4OH-~4NaOH得:Al3+完全转换为AlO2-消耗的NaOH的物质的量=0.02mol×4=0.08mol,所以使Mg2+转换为沉淀完全分离出来消耗NaOH的物质的量最少值=0.06mol+0.08mol=0.14mol,体积为V=![]() =0.14L=140mL,即使Mg2+转换为沉淀完全分离出来消耗1mol/L的NaOH最少140mL。
=0.14L=140mL,即使Mg2+转换为沉淀完全分离出来消耗1mol/L的NaOH最少140mL。
答案选A。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某混合物X由Al2O3、Fe2O3、Cu、SiO2中的一种或几种物质组成。某课外兴趣小组对X进行如下实验探究:

下列说法正确的是( )
A. 12.8g固体可能为Fe2O3 B. 混合物X的成分为Al2O3、Fe2O3、Cu、SiO2
C. Fe2O3、Cu的物质的量之比为1:1 D. m>24.8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积可变的密闭容器中存在如下反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) △H<0,
CO2(g)+H2(g) △H<0,
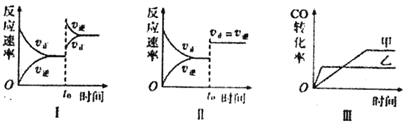
下列分析中正确的是
A. 图I研究的是t0时增大反应物浓度对反应速率的影响
B. 图II中t0时改变的条件只能是增大压强
C. 图III研究的是催化剂对化学平衡的影响,且乙使用了催化剂
D. 图III研究的是温度对化学平衡的影响,且乙的温度较高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物W在医药和新材料等领域有广泛应用。W的一种合成路线如图:
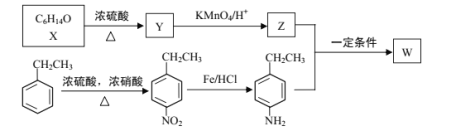
已知部分信息如下:
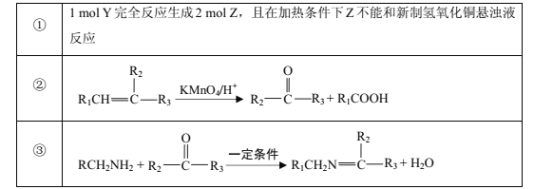
请回答下列问题:
(1)Y的化学名称是___;Z中官能团的名称是___;
(2)![]() 中___(填“有”或“无”)手性碳原子;图示中X转化为Y的反应类型是___。
中___(填“有”或“无”)手性碳原子;图示中X转化为Y的反应类型是___。
(3)生成W的化学方程式为___。
(4)G是对硝基乙苯的同分异构体,G能和碳酸钠反应产生气体且分子中含有—NH2(氨基),G的同分异构体有___种(不考虑立体结构),其中在核磁共振氢谱上峰的面积比为1∶2∶2∶2∶2的结构简式为___。
(5)设计以苯乙烯和丙酮为原料制备药物中间体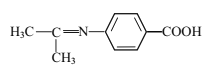 的合成路线___(无机试剂自选)。
的合成路线___(无机试剂自选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列说法中正确的是
A.某密闭容器中盛有0.2molSO2和0.1molO2,一定条件下充分反应,生成SO3分子数为0.2NA
B.25℃时,1.0LpH=13的Ba(OH)2溶液中含有的OH-数目为0.1NA
C.25℃时,0.1mol·L-1Na2S溶液中含有Na+的数目为0.2NA
D.将1mL5.68mol·L-1的FeCl3饱和溶液制成胶体,可得到0.00568NA个Fe(OH)3胶粒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,可逆反应![]() 在体积固定的密闭容器中反应,达到平衡状态的标志是( )
在体积固定的密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成nmolO2,同时生成2nmol![]()
②混合气体的压强不再改变
③混合气体的平均相对分子质量不再改变
④单位时间内生成nmolO2,同时生成2nmolNO
⑤混合气体的颜色不再改变
⑥用![]() 、NO、
、NO、![]() 的物质的量浓度变化表示的反应速率的比为2:2:1
的物质的量浓度变化表示的反应速率的比为2:2:1
A.①④⑤⑥B.①②③⑤C.②③④⑥D.以上全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:25℃时,Kb(NH3·H2O)=1.8×10-5。该温度下,用0.100mol·L-1氨水滴定10.00mL0.100mol·L-1一元酸HA的溶液.滴定过程中加入氨水的体积(V)与溶液中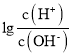 的关系如图所示。下列说法不正确的是
的关系如图所示。下列说法不正确的是
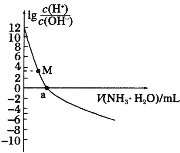
A.HA为强酸
B.a=10
C.M点时,c(A-)>c(NH4+)>c(H+)>c(OH-)
D.当滴入20mL氨水时,溶液中存在c(NH4+)>c(A-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20 mL 0.01 mol/L CH3COOH溶液中逐滴加入0.01 mol/L 的NaOH溶液,溶液中水所电离出的c(H+)随加入NaOH溶液的体积变化示意图如下,下列说法正确的是
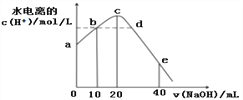
A. 从a到c,对醋酸的电离既有促进作用也有抑制作用
B. b、d两点溶液的pH相同
C. e点所示溶液中,c(Na+)=2c(CH3COO-)+2c(CH3COOH) = 0.01mol/L
D. 从b→d的过程中,既存在pH=7的点也存在水电离的c(H+)=10-7的点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钠(Na2FeO4)是水处理过程中常用的一种新型净水剂,在反应中被还原成Fe3+离子,工业上常用NaClO氧化Fe(OH)3生产高铁酸钠:
完成下列填空:
(1)配平上述化学方程式:___ Fe(OH)3 + ___ NaClO + ___ NaOH → ____ Na2FeO4 +___ NaCl +___ H2O
(2)其中发生还原反应的元素是__________;若制备过程中消耗了0.15 mol NaClO,则转移的电子数目是____________________。
(3)高铁酸钠之所以能净水,除了能杀菌消毒外,另一个原因是(结合离子方程式回答)_________________________________________________。
(4)生产高铁酸钠的另一种方法是电解法,原理是Fe + 2NaOH + 2 H2O → Na2FeO4 + 3 H2↑
则电解过程中Fe在_________。(选填编号)
a. 阳极发生氧化反应 b. 阴极发生还原反应
c. 阳极发生还原反应 d. 阴极发生氧化反应
(5)某地海水样品经Na2FeO4处理后,所含离子及其浓度如下表所示(H+和OH-未列出):
离子 | SO42- | Mg2+ | Fe3+ | Na+ | Cl- |
浓度(mol/L) | a | 0.05 | 0.10 | 0.50 | 0.58 |
表格中的a_______0.16 (填“>”、“<”或“=”),判断的理由是______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com