
【题目】将下列各种液体:①苯;② 四氯化碳;③碘化钾溶液;④乙烯;⑤植物油,分别与溴水混合后充分振荡、静置,液体分为两层,原溴水层几乎是无色的是
A.②⑤ B.只有②④
C.①②④⑤ D.①②③④⑤
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】己知:还原性HSO3->I-,氧化性IO3->I2。在含3 mol NaHSO3的溶液中逐滴加入KIO3溶液.加入KIO3和析出I2的物质的量的关系曲线如下图所示。下列说法不正确的是( )

A. 0~a间发生反应:3HSO3-+IO3-=3SO42-+I-+3H+
B. a~b间共消耗NaHSO3的物质的量为1.8mol
C. b~c间反应:I2仅是氧化产物
D. 当溶液中I-与I2的物质的量之比为5∶3时,加入的KIO3为1.08mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】需要配制2mol/L的NaCl溶液480mL,配制时应选用的容量瓶的规格和称取的NaCl质量分别是( )
A.480mL,56.2g
B.500mL,56.2g
C.500mL,58.5g
D.任意规格,56.2g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、R、T的原子半径与原子序数关系如图所示。其中X是原子半径最小的元素,R原子最外层电子数是电子层数的2倍,Y与Z能形成Z2Y、Z2Y2型离子化合物, T与Y 是同一主族元素。

(1)RX4的空间构型_____________,R在元素周期表中的位置_______________。
(2)比较X2Y、X2T稳定性强弱_________________(填化学式)
(3)判断RY2是________化合物(填“离子”或“共价”)写出RY2电子式____________,
(4)写出一个能判断R、T非金属性强弱的化学方程式________________________________。
(5)写出氯碱工业上制取Z、Y、X的离子方程式_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关烯烃的说法中,正确的是
A. 烯烃分子中所有的原子一定在同一平面上
B. 烯烃在适宜的条件下只能发生加成反应不能发生取代反应
C. 分子式是C4H8的烃分子中一定含有碳碳双键
D. 通过石油的催化裂化及裂解可以得到气态烯烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将1.000mol/L盐酸滴入20.00mL 1.000mol/L氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是
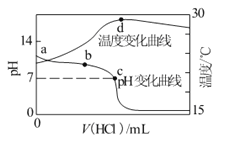
A.a点由水电离出的c(H+)=1.0×10-14molL-1
B.b点:c(NH4+)+c(NH3H2O)=c(Cl-)
C.c点:c(Cl-)=c(NH4+)
D.d点后,溶液温度略下降的主要原因是NH3H2O电离吸热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】直接氨硼烷(NH3·BH3)电池可在常温下工作,装置如下图,该电池的总反应为NH3·BH3+3H2O2=NH4BO2+4H2O。下列说法正确的是( )
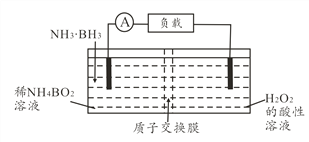
A. 左侧电极发生还原反应
B. 电池工作时,H+通过质子交换膜向负极移动
C. 正极的电极反应式为2H++2e-=H2↑
D. 消耗3.1g氨硼烷,理论上转移0.6mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.甲烷—空气燃料电池若以KOH溶液为电解质溶液,负极的电极反应式为______________;若以稀硫酸为电解质溶液,正极的电极反应式为 __________________________。
Ⅱ.现有纯铁片、纯银片、纯铜片,稀硫酸、FeSO4溶液、Fe2(SO4)3溶液、大烧杯、导线若干,请运用原电池原理设计实验,验证Cu2+、Fe3+的氧化性强弱。
(1)写出电极反应式,负极:__________________,正极:___________________。
(2)请在下面方框中画出原电池的装置图,标出外电路电子流向(注明电极材料、电解质溶液,连成闭合回路)________。

该装置反应一段时间后,当溶液的质量增加3.2 g时,通过导线的电子的数目是_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com