
| A. | 在放电时,正极发生的反应是Pb+SO42-═PbSO4+2e- | |
| B. | 在放电时,该电池的负极材料是铅板 | |
| C. | 在充电时,电池中硫酸的浓度不断变小 | |
| D. | 在充电时,阳极发生的反应是PbSO4+2e-═Pb+SO42- |
分析 铅蓄电池放电时,Pb为负极,发生氧化反应,电极方程式为Pb+SO42--2e-=PbSO4,PbO2为正极,发生还原反应,电极方程式为PbO2+4H++SO42--2e-=2H2O+PbSO4,在充电时,阴极发生的反应是PbSO4+2e-=Pb+SO42-,阳极反应为PbSO4-2e-+2H2O=PbO2+SO42-+4H+,放电时,阴离子向负极移动,阳离子向正极移动,以此解答该题
解答 解:A.正极上二氧化铅得电子发生还原反应,电极反应式为PbO2+4H++SO42-+2e-=PbSO4(s)+2H2O,故A错误;
B.铅蓄电池放电时,Pb为负极,故B正确;
C.充电时,阴极发生的反应是PbSO4+2e-=Pb+SO42-,阳极反应为PbSO4-2e-+2H2O=PbO2+SO42-+4H+,总反应为2PbSO4+2H2O=Pb+PbO2+2H2SO4,所以硫酸的浓度不断变大,故C错误;
D.在充电时,阳极反应为PbSO4-2e-+2H2O=PbO2+SO42-+4H+,故D错误;
故选B.
点评 本题考查原电池和电解池知识,侧重于学生的分析能力和电化学知识的综合考查,为高考常见题型和高频考点,注意把握电解方程式的书写,难度不大.


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:选择题
| A. | 它可能能使酸性高锰酸钾溶液褪色 | |
| B. | 一氯代物可能只有一种 | |
| C. | 分子结构中甲基的数目可能是0、1、2 | |
| D. | 等质量CH4和C4H8分别在氧气中完全燃烧,CH4的耗氧量小于C4H8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
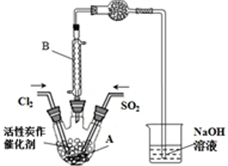 已知:SO2(g)+Cl2(g)+SCl2(g)?2SOCl2(g)△H=-a kJ•mol-1
已知:SO2(g)+Cl2(g)+SCl2(g)?2SOCl2(g)△H=-a kJ•mol-1| SO2Cl2 | Cl2 | SO2 | |
| 熔点/℃ | -54.1 | -101 | -72.4 |
| 沸点/℃ | 69.1 | -34.6 | -10 |
| 性质 | 遇水发生剧烈水解 | / | / |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

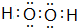 ,化合物E2 D2与化合物E2H的水溶液按物质的量比1:1反应生成单质H的离子方程式为Na2O2+2H2O+S2-=S+4Na++4OH-
,化合物E2 D2与化合物E2H的水溶液按物质的量比1:1反应生成单质H的离子方程式为Na2O2+2H2O+S2-=S+4Na++4OH-查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HClO的结构式:H-Cl-O | B. | 氨气分子的比例模型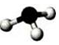 | ||
| C. | 原子核内有10个中子的氧原子:18O | D. | H2与H+互为同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向海水中加入明矾可以使海水淡化,用于解决淡水供应危机 | |
| B. | 大力推广农作物的生物防治技术,以减少农药的使用 | |
| C. | 将地沟油回收再加工为食用油,以减缓水体富营养化 | |
| D. | 用聚氯乙烯代替木材,生产包装盒、快餐盒等,以减少木材的使用 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ;与E同周期的元素中,金属性最弱的金属元素名称是铝,最稳定的气态氢化物的化学式为HCl;
;与E同周期的元素中,金属性最弱的金属元素名称是铝,最稳定的气态氢化物的化学式为HCl; ,B与D通常能形成共价(填“离子”或“共价”)化合物,在E2D2中含有的化学键有离子键、非极性共价键.
,B与D通常能形成共价(填“离子”或“共价”)化合物,在E2D2中含有的化学键有离子键、非极性共价键.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
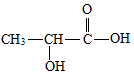 乳酸是世界上公认的三大有机酸之一,其应用非常广泛,可用作食品酸味剂、医药防腐剂、工业pH调节剂等.乳酸的结构简式如图所示.
乳酸是世界上公认的三大有机酸之一,其应用非常广泛,可用作食品酸味剂、医药防腐剂、工业pH调节剂等.乳酸的结构简式如图所示.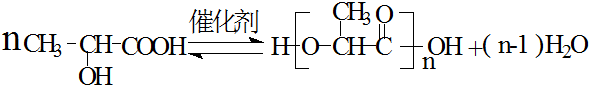 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com