
【题目】镓(Ga)、锗( Ge)、砷(As)、硒(Se)均为第四周期的元素,它们在高科技尖端科学特别是信息领域有着广泛的用途。试回答下列问题:
(1)基态锗原子的价电子排布图为_____。
(2)沸点:NH3_______AsH3(填“>”、“<”或“=”),原因是____________。
(3)H2SeO4和H2SeO3是硒的两种含氧酸,请根据结构与性质的关系,解释H2SeO4比H2SeO3 酸性强的原因________。
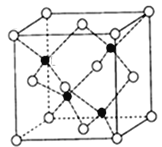
(4)砷化镓可由(CH3)3Ga和AsH3在700℃下反应制得,同时得到一种最简单的有机物,写出该反应的方程式为_____;砷化镓的晶胞结构如下图所示,其晶胞边长为a pm(1pm=10-12m),则每立方厘米该晶体中所含砷元素的质量为_____g(用NA表示阿伏加德罗常数的值)。
【答案】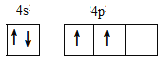 > NH3分子间存在氢键,所以NH3沸点高于AsH3 H2SeO4与H2SeO3比较前者非羟基氧多(或H2SeO3中的Se为+4价,而H2SeO4中的Se为+6价,导致Se-O-H中的O的电子更向Se偏移,越易电离出H+) (CH3)3Ga +AsH3
> NH3分子间存在氢键,所以NH3沸点高于AsH3 H2SeO4与H2SeO3比较前者非羟基氧多(或H2SeO3中的Se为+4价,而H2SeO4中的Se为+6价,导致Se-O-H中的O的电子更向Se偏移,越易电离出H+) (CH3)3Ga +AsH3![]() GaAs +3CH4
GaAs +3CH4 ![]()
【解析】
(1)锗是第四周期第ⅣA族元素,原子序数是32,所以依据核外电子排布规律可知,基态锗原子的价电子排布式为4s24p2,价电子排布图为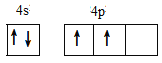 ,故答案为:
,故答案为: 。
。
(2)由于氮元素的非金属性强,因此NH3分子间存在氢键,所以NH3沸点高于AsH3沸点,故答案为:>;NH3分子间存在氢键,所以NH3沸点高于AsH3。
(3)由于H2SeO4和H3SeO3可表示为(HO)2SeO2和(HO)3Se,H2SeO4中非羟基氧多,H2SeO3中的Se为+4价,而H2SeO4中的Se为+6价,导致Se-O-H中的O的电子更向Se偏移,越易电离出H+,所以H2SeO4比H2SeO3酸性强,故答案为:H2SeO4与H2SeO3比较前者非羟基氧多(或H2SeO3中的Se为+4价,而H2SeO4中的Se为+6价,导致Se-O-H中的O的电子更向Se偏移,越易电离出H+)。
(4)砷化镓可由(CH3)2Ga和AsH3在700℃下反应制得,则根据原子守恒可知,另外一种生成物是甲烷,则该反应的方程式为(CH3)3Ga+AsH3![]() GaAs+3CH4;根据晶胞结构可知GaAs晶体中,每个As与4个Ga相连,且As原子全部在晶胞里面,共计是4个。晶胞边长为apm,所以晶胞的体积是a3pm3,所以每立方厘米含该晶胞的个数是
GaAs+3CH4;根据晶胞结构可知GaAs晶体中,每个As与4个Ga相连,且As原子全部在晶胞里面,共计是4个。晶胞边长为apm,所以晶胞的体积是a3pm3,所以每立方厘米含该晶胞的个数是![]() ,因此含有的As原子个数是
,因此含有的As原子个数是![]() ×4,物质的量是
×4,物质的量是![]() mol,所以As元素的质量是
mol,所以As元素的质量是![]() mol×75g/mol=
mol×75g/mol=![]() g,故答案为:(CH3)3Ga+AsH3
g,故答案为:(CH3)3Ga+AsH3![]() GaAs+3CH4;
GaAs+3CH4;![]() 。
。


科目:高中化学 来源: 题型:
【题目】下列过程中所发生的化学变化属于取代反应的是( )
A.苯与浓溴水混合后撒入铁粉
B.乙醇、乙酸与浓硫酸混合后加热
C.在加热及镍作催化剂的条件下,苯与氢气反应
D.在加热及铜作催化剂的条件下,乙醇与氧气反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由CH3CH2CH2Br制备CH3CH(OH)CH2OH,依次发生的反应类型和反应条件都正确的是
选项 | 反应类型 | 反应条件 |
A | 加成、取代、消去 | KOH醇溶液/加热、KOH水溶液/加热、常温 |
B | 消去、加成、取代 | NaOH醇溶液/加热、常温、KOH水溶液/加热 |
C | 氧化、取代、消去 | 加热、KOH醇溶液/加热、KOH水溶液/加热 |
D | 消去、加成、水解 | NaOH水溶液/加热、常温、NaOH醇溶液/加热 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X为一种常见酸的浓溶液,能使蔗糖粉末变黑。A与X反应的转化关系如图所示,
其中反应条件及部分产物均已略去,则下列有关说法正确的是
A.X使蔗糖变黑的现象主要体现了X的强氧化性
B.若A为铁,则足量A与X在室温下即可完全反应
C.若A为碳单质,则将C通入少量的澄清石灰水中,最后有白色沉淀产生
D.工业上,B转化为D的反应条件为加热、使用催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,N2O分解的部分实验数据如下( )
反应时间/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
c(N2O)/molL-1 | 0.100 | 0.090 | 0.080 | 0.070 | 0.060 | 0.050 | 0.040 | 0.030 | 0.020 | 0.010 | 0.000 |
下图能正确表示该反应有关物理量变化规律的是( )
(注:图中半衰期指任一浓度N2O消耗一半时所需的相应时间,c1、c2均表示N2O初始浓度且c1<c2)
A.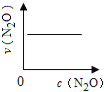 B.
B.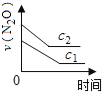 C.
C.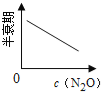 D.
D.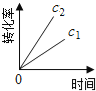
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】小明在课外阅读中得知:氢氧化铜受热会分解生成氧化铜(Ca(OH)2=CuO+X),于是用CuSO4溶液与KOH溶液反应制取氢氧化铜,并对氢氧化铜进行加热。
(1)生成物X的化学式为___________。
(2)制取氢氧化铜的化学方程式为______________________。
(3)小明在加热氢氧化铜时,发现蓝色固体先变成黑色;继续高温灼烧黑色固体变成红色,同时有气体产生。为弄清这种红色固体的成份,进行了如下的探究:
(查阅资料)Cu和Cu2O均为红色固体,且Cu2O+H2SO4=Cu+CuSO4+H2O。
(提出猜想)红色固体是:Ⅰ.Cu Ⅱ.Cu2O Ⅲ. ______________________。
(进行实验)
操作 | 现象 | 结论 |
①取灼烧后的红色固体1.44g于试管中,加入足量稀硫酸,加热并充分震荡,静置。 | 溶液由无色变蓝色,固体减少。 | 1.44g红色固体一定有:____________________ |
②过滤、洗涤、干燥。 | 得红色固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组取部分变质的Ca(OH)2(含杂质CaCO3)样品4.0g投入200.0g水中,充分搅拌,通入足量CO2,溶液质量与反应的CO2质量的关系如图所示.则:
(1)以Ca(OH)2全部转化为CaCO3时消耗的CO2质量为_____g;
(2)4.0g样品中杂质CaCO3的质量为______________?(写出计算过程)
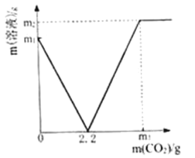
(3)通入m3gCO2时,溶液中生成物的溶质的质量分数为_____(精确到0.1%).若所取样品中的Ca(OH)2没有完全溶于水,对最后的计算结果_____(填“有”、“没有”)影响.原因是_____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A. 氯气溶于水:Cl2+H2O2H++Cl﹣+ClO﹣
B. 向FeSO4溶液中加入H2SO4酸化的KMnO4溶液:5Fe2++MnO4﹣+8H+═5Fe3++Mn2++4H2O
C. 向少量澄清石灰水中加入足量的NaHCO3溶液:Ca2++OH﹣+HCO3﹣═CaCO3↓+H2O
D. 用铜做电极电解NaCl溶液:2Cl﹣+2H2O![]() H2↑+Cl2↑+2OH﹣
H2↑+Cl2↑+2OH﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C和甲、乙、丙均是由短周期元素形成的物质,D是过渡元素形成的常见单质,它们之间能发生如下反应。(图中有些反应的产物和反应条件没有标出)

请根据以上信息回答下列问题:
(1)写出下列物质的化学式
A________、B_______、C_______、F________、 H_____________、乙_________
(2)写出下列反应的离子方程式:④_____________⑤___________
(3)金属D与稀硫酸反应,产生标准状况下1.12L的H2气体,则参加反应的硫酸为_______mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com