
| A. | 铁表面镀铜时,铁与电源的正极相连,铜与电源的负极相连 | |
| B. | 向氨水中不断通入CO2,随着CO2的增加,$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$不断增大 | |
| C. | 3C(s)+CaO(s)=CaC2(s)+CO(g)在常温下不能自发进行,说明该反应的△H>0 | |
| D. | 合成氨时,其他条件不变升高温度,反应速率v(H2)和氢气的平衡转化率均增大 |
分析 A.电镀池中,作阳极的是镀层金属,做阴极的是待镀金属;
B.向氨水中不断通入CO2,一水合氨浓度减小,铵根离子浓度增大,结合电离常数分析;
C.根据反应自发进行的判断依据△H-T△S<0分析解答;
D.合成氨反应为放热反应.
解答 解:A.在铁件的表面镀铜的电镀池中,作阳极的是镀层金属铜,与电源的正极相连,阳极上金属铜失电子发生氧化反应,阴极上铜离子得电子生成铜单质,铁与电源的负极相连做阴极,故A错误;
B.向氨水中不断通入CO2,一水合氨浓度减小,铵根离子浓度增大,由于$\frac{c(N{{H}_{4}}^{+})×c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$是常数,所以$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$不断减小,故B错误;
C.3C(s)+CaO(s)=CaC2(s)+CO(g)在常温下不能自发进行,已知△S>0,由△H-T△S<0可知,说明该反应的△H>0,故C正确;
D.合成氨反应为放热反应,升高温度反应速率加快,平衡逆向移动,所以氢气的转化率减小,故D错误;
故选C.
点评 本题考查了电镀原理的应用、弱电解质的电离、反应自发进行的判断以及化学平衡的影响因素等知识点,题目难度中等,侧重于考查学生对基础知识的应用能力.


 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源:2016-2017学年浙江省高一上10月月考化学试卷(解析版) 题型:选择题
下列关于物质的类别的说法不正确的是
A.能在水溶液中或熔融状态下导电的化合物就是电解质
B.胶体是一种能产生丁达尔效应的分散系
C.纯碱不属于碱,干冰属于酸性氧化物
D.Na2O和Na2O2都能与水反应生成对应的碱,它们都是碱性氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
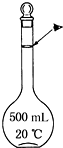 实验室配制500mL 0.5mol•L-1的NaCl溶液,有如下操作步骤:
实验室配制500mL 0.5mol•L-1的NaCl溶液,有如下操作步骤:查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津市高一上9月调研化学试卷(解析版) 题型:选择题
将下列溶液与1 L 0.1 mol·L-1 NaCl溶液混合,所得溶液c(Cl-)最大的是
A.50 mL 1 mol·L-1 NaCl溶液 B.20 mL 2 mol·L-1 A lCl3溶液
lCl3溶液
C.30 mL 1 mol·L-1 MgCl2溶液 D.100 mL 3 mol·L-1 KClO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
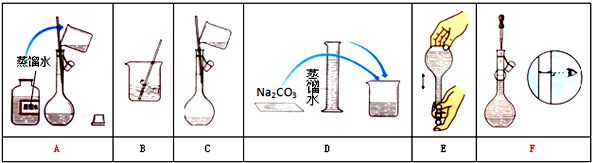
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 二氧化氯(C1O2)是目前国际上公认的第四代高效、无毒的消毒剂,是一种黄绿色的气体,易溶于水.实验室可用Fa-14Cl、盐酸、NaCl02(亚氯酸钠)为原料制备C1O2的流程如下:
二氧化氯(C1O2)是目前国际上公认的第四代高效、无毒的消毒剂,是一种黄绿色的气体,易溶于水.实验室可用Fa-14Cl、盐酸、NaCl02(亚氯酸钠)为原料制备C1O2的流程如下: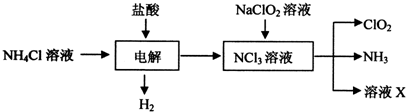
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 聚2-甲基-1-丙烯可以通过加聚反应制得 | |
| B. | 聚2-甲基-1-丙烯的分子式为 (C4H8)n | |
| C. | 聚2-甲基-1-丙烯完全燃烧生成CO2和H2O的物质的量相等 | |
| D. | 聚2-甲基-1-丙烯能使溴的四氯化碳溶液褪色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com