
【题目】以氯化钠和硫酸铵为原料制备氯化铵及副产品硫酸钠的工艺流程如下:
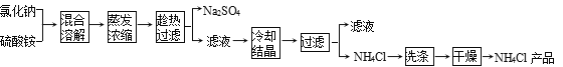
【查阅资料】
①上述流程所示物质中只有NH4Cl受热易分解:NH4Cl![]() NH3↑+HCl↑
NH3↑+HCl↑
②氯化铵和硫酸钠的溶解度随温度变化曲线如下图所示:
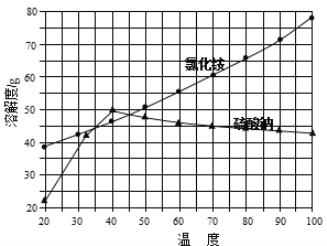
请回答下列问题:
(1)写出氯化钠和硫酸铵溶液混合得到硫酸钠晶体的化学方程式: 。
(2)欲制备10.7 g NH4Cl,理论上需NaCl质量为 g。
(3)实验室进行蒸发结晶用到的主要仪器除铁架台、铁圈、酒精灯外,还要有 。
(4)“冷却结晶”过程中,析出NH4Cl晶体的合适温度为 。
(5)不用其它试剂,检查NH4Cl产品是否纯净的方法:
操作步骤 | 现象 | 结论 |
取少量氯化铵产品于试管底部, | 表明氯化铵产品纯净 |
【答案】(1)2NaCl+(NH4)2SO4=2NH4Cl+Na2SO4↓(3分)
(2)11.7(2分)(3)蒸发皿(2分)、玻璃棒(2分)
(4)35℃(3分)加热,试管底部没有残留物(2分)
【解析】
试题分析:(1)氯化钠和硫酸铵溶液混合得到硫酸钠晶体的化学方程式为2NaCl + (NH4)2SO4=2NH4Cl + Na2SO4 ↓;
(2)通过分析,依据氯元素守恒可知,1mol氯化钠会生成1mol氯化铵,所以根据NH4Cl---NaCl可知欲制备10.7gNH4Cl即0.2mol氯化铵,理论上需NaCl的质量=0.2mol×58.5g/mol=11.7g;
(3)实验室进行蒸发浓缩用到的主要仪器有蒸发皿、烧杯、玻璃棒、酒精灯等;
(4)根据硫酸钠的溶解度曲线不难看出,在低于40℃时,硫酸钠的溶解度随温度的升高而增大,高于40℃时硫酸钠的溶解度随温度的升高而减小;由两物质的溶解度曲线不难看出,只有在35-45℃时,氯化铵的溶解度小于硫酸钠的溶解度,所以析出NH4Cl晶体的合适温度为35~45℃;
(5)根据氯化铵受热时分解生成了氨气和氯化氢气体,可用加热法检查NH4Cl产品是否纯净,操作是:取少量氯化铵产品于试管底部,加热,若试管底部无残留物,表明氯化铵产品纯净。


 互动英语系列答案
互动英语系列答案科目:高中化学 来源: 题型:
【题目】某同学设计如下实验方案,以分离KCl和BaCl2两种固体混合物。试回答下列问题:
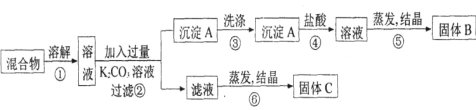
(1) B物质的化学式为 。
(2) 该方案的明显失误是因某一步设计不当而使分离产物不纯,该步骤是 (填序号)如何改进 ,所涉及反应的离子方程式为 。
(3)写出 ② ④ 两步中对应的离子方程式:
② ;
④____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)火药是中国的“四大发明”之一,永远值得炎黄子孙骄傲,也永远会激励着我们去奋发图强。黑火药在发生爆炸时,发生如下的反应:2KNO3+C+S===K2S+2NO2↑+CO2↑。被氧化的元素是 ,氧化剂是 ,还原产物是 。电子转移的总数为__________。
(2)国家卫生部在2000年前就决定逐步使用稳定、高效、无毒的二氧化氯取代氯气消毒饮用水。已知二氧化氯溶于水时有亚氯酸根离子(ClO2-)生成,且氧化产物与还原产物的物质的量之比为1∶1。二氧化氯溶于水的反应方程式2ClO2 + H2O=HClO3 + HClO2,请用单线桥标明电子转移方向和数目并指出氧化产物。2ClO2 + H2O=HClO3 + HClO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用稀硝酸腐蚀废锌板后得到“烂版液”(含有微量的Cl-、Fe3+),某化学兴趣小组拟用该“烂版液”制取Zn(NO3)2·6H2O的过程如下:
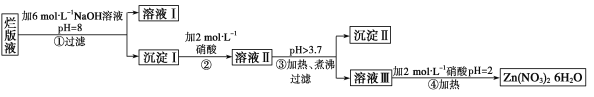
已知: Zn(NO3)2能与碱反应,得到的产物具有两性。
(1)为检验“烂版液”中的Fe3+,下列试剂可选择的是 (填选项的代号)
A、NaOH溶液 B、KSCN溶液 C、K3[Fe(CN)6] 溶液 D、NaCl溶液
(2)若稀硝酸腐蚀锌板产生的气体为N2O,写出稀硝酸腐蚀锌板反应的主要化学方程式_________。
(3)在操作①中保持pH=8的目的是___________;操作④保持pH=2的目的是__________________;
(4)操作③中加热、煮沸的目的是___________________________;
(5)沉淀Ⅱ的主要成分是______________________。
(6)已知金属活泼性不同,其硝酸盐的分解产物也不同。
2KNO3=2KNO2+O2↑ 4Fe(NO3)2=2Fe2O3+8NO2↑+O2↑ 2Zn(NO3)2=2ZnO+4NO2↑+O2↑
某同学取KNO3、Zn(NO3)2、Fe(NO3)2混合粉末充分加热后,用排水法未收集到任何气体,则KNO3、 Zn(NO3)2、Fe(NO3)2的物质的量之比为 (填选项的代号)
A、2︰1︰3 B、1︰2︰2 C、1︰2︰3 D、3︰8︰5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图为部分元素在元素周期表中的相对位置。据此回答相关问题:

(1)其中非金属性最强的是 (填元素符号)。
(2)N、P两种元素的最高价氧化物对应的水化物的酸性:HNO3 H3PO4(填“>”、“=”或“<”)。
(3)O位于元素周期表中的第 族。
(4)S、Cl两种元素氢化物的稳定性:H2S HCl(填“>”、“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.油脂水解可得到氨基酸
B.蛋白质水解可以得到高级脂肪酸
C.维生素是一类高分子化合物
D.淀粉和纤维素的组成的化学式可表示为(C6H10O5)n,水解最终产物都是葡萄糖
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验基本操作或对事故的处理方法不正确的是( )
A.给盛有液体的烧瓶加热时,需要加碎瓷片或沸石
B.发现实验室中有大量的可燃性气体泄漏时,应立即开窗通风
C.酒精灯内的酒精不能超过酒精灯容积的2/3
D.不慎将少量浓硫酸溅到皮肤上,应立即用水冲洗,然后涂抹10%的NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:
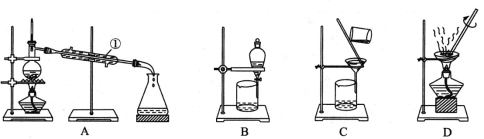
(1)从氯化钾溶液中得到氯化钾固体,选择装置 (填代表装置图的字母,下同);除去自来水中的Cl-等杂质,选择装置 。
(2)从碘水中分离出I2,选择装置 。该分离方法的名称为 。
(3)装置A中①的名称是 ,进水的方向是从 口进水。装置B在分液时为使液体顺利滴下,除打开活塞外,还应进行的具体操作是 。
(4)海水中蕴藏着丰富的资源,取少量海水在实验室中进行如下流程的实验:
![]()
粗盐中含Ca2+、Mg2+、Fe3+、SO42-等杂质,需要提纯后才能综合利用。粗盐提纯的步骤有:①加入过量的Na2CO3溶液;②加入过量的BaCl2溶液;③加入过量的NaOH溶液;④调节溶液的pH等于7;⑤溶解;⑥过滤;⑦蒸发。
正确的操作顺序是 (填写序号)。
A.⑤②③①⑥④⑦ B.⑤①②③⑥④⑦
C.⑤②①③④⑥⑦ D.⑤③②①⑥④⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaCl溶液中混有Na2SO4、CaCl2溶液和淀粉胶体,选择适当的试剂和方法从中提纯出NaCl晶体。相应的实验过程如下:
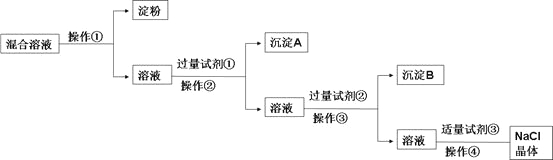
(1)写出上述实验过程中所用试剂(写化学式):
试剂①___________________;试剂③________________。
(2)判断试剂①已过量的方法是:________________________。
(3)用化学方程式表示加入试剂②的作用:_______________________。
(4)操作①是利用半透膜进行分离提纯。
操作①的实验结果:淀粉_____________(填“能”或“不能”)透过半透膜;SO42-_____________(填“能”或“不能”)透过半透膜;请用实验证明上述结果,完成下表(可不填满,也可增加):限选试剂:1mol/L AgNO3溶液、1mol/L BaCl2溶液、1mol/L Ba(NO3)2溶液、碘水、稀盐酸、稀硝酸
编号 | 实验操作 | 预期现象和结论 |
① | ||
② |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com