

分析 由实验流程可知,含锌物料为原料,采用硫酸浸出锌,过滤除杂,得到滤液中含锌离子,与加入的Na2CO3溶液反应生成碱式碳酸锌,最后焙解获得活性氧化锌.
(1)Na的焰色为黄色,以此检验;金属元素常用焰色反应;
(2)pH=12的Na2CO3溶液,n(Na)=2n(C),c(OH-)=0.01mol/L;
(3)Fe2+、Cu2+等杂质,均可与碳酸钠反应;适量KMnO4将Fe2+转化为Fe(OH)3,由电子守恒计算;
(4)Cu2+浓度为0.002mol•L-1,转化为沉淀时c(OH-)=$\sqrt{\frac{Ksp}{c(C{u}^{2+})}}$;
(5)“煅烧”反应生成ZnO、二氧化碳和水.
解答 解:由实验流程可知,含锌物料为原料,采用硫酸浸出锌,过滤除杂,得到滤液中含锌离子,与加入的Na2CO3溶液反应生成碱式碳酸锌,最后焙解获得活性氧化锌.
(1)Na的焰色为黄色,则检验溶液中含有Na+,常用焰色反应,具体操作为:将铂丝蘸盐酸在无色火焰上灼烧至无色,再蘸取待测溶液在无色火焰上灼烧,观察火焰颜色,再将铂丝再蘸盐酸灼烧至无色,
故答案为:焰色反应;将铂丝蘸盐酸在无色火焰上灼烧至无色,再蘸取待测溶液在无色火焰上灼烧,观察火焰颜色,再将铂丝再蘸盐酸灼烧至无色;
(2)pH=12的Na2CO3溶液,由化学式可知,n(Na)=2n(C),则c(Na+)=2×0.51 mol/L=1.02 mol/L,c(OH-)=0.01mol/L,所以c(Na+):c(OH-)=102:1,故答案为:102:1;
(3)溶解后得到酸性溶液,要调节溶液的pH至5.4,需要升高pH,故应加入Na2CO3 n(Fe2+)=0.009 mol,由电子得失守恒,则n(KMnO4)=$\frac{0.009mol}{(7-4)}$=0.003 mol,故答案为:Na2CO3;0.003;
(4)Cu2+浓度为0.0002mol•L-1,c(Cu2+)•[c(OH-)]2=2×10-20时开始出现沉淀,c(OH-)=$\sqrt{\frac{Ksp}{c(C{u}^{2+})}}$=$\sqrt{\frac{2×1{0}^{-20}}{0.0002}}$=10-8 mol•L-1,pH=6,故答案为:6;
(5)“煅烧”反应生成ZnO、二氧化碳和水,反应为ZnCO3•2Zn(OH)2•H2O$\frac{\underline{\;450℃-500℃\;}}{\;}$3ZnO+CO2↑+3H2O↑,
故答案为:ZnCO3•2Zn(OH)2•H2O$\frac{\underline{\;450℃-500℃\;}}{\;}$3ZnO+CO2↑+3H2O↑.
点评 本题考查学生对工艺流程的理解、阅读获取信息能力、对操作步骤的分析评价、物质的分离提纯、氧化还原反应计算等,是对所学知识的综合运用与能力的考查,需要学生具备扎实的基础知识与综合运用知识、信息进行解决问题的能力,题目难度中等.


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| 元素 | I1 | I2 | I3 | I4 |
| X | 496 | 4562 | 6912 | 9543 |
| Y | 578 | 1817 | 2745 | 11600 |
| A. | 元素X的常见化合价是+1价 | |
| B. | 元素Y是ⅢA族的元素 | |
| C. | 元素X与氯形成化合物时,化学式可能是XCl | |
| D. | 若元素Y处于第3周期,它可与冷水剧烈反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 欲设计一个实验,验证红热的炭与浓硫酸发生反应所生成的各种产物.有一位同学按气体的流动方向设计了一个实验流程,其所使用的试剂顺序可表示为:气体产物→无水硫酸铜固体→品红溶液→酸性高锰酸钾溶液→品红溶液→澄清石灰水.
欲设计一个实验,验证红热的炭与浓硫酸发生反应所生成的各种产物.有一位同学按气体的流动方向设计了一个实验流程,其所使用的试剂顺序可表示为:气体产物→无水硫酸铜固体→品红溶液→酸性高锰酸钾溶液→品红溶液→澄清石灰水.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
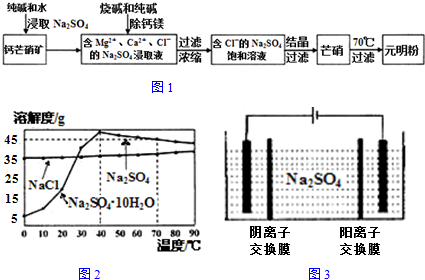
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
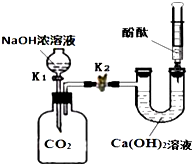 某兴趣小组在探究二氧化碳与氢氧化钠溶液反应的实验中,做了如图所示的实验.
某兴趣小组在探究二氧化碳与氢氧化钠溶液反应的实验中,做了如图所示的实验.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室制乙炔并检验其性质的装置如图.
实验室制乙炔并检验其性质的装置如图.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com