
【题目】在一密闭容器中充入a mol NO和b mol O2,可发生如下反应:2NO+O2===2NO2,充分反应后容器中氮原子和氧原子的个数之比为( )
A. a : b B. a : 2b C. a:(a+2b) D. a : 2(a+b)
 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源: 题型:
【题目】下列各组中能分别代替KClO3和镁带引发铝热反应的是( )
A.直接用酒精喷灯加热
B.KMnO4、铝条
C.火柴头、浓盐酸
D.KMnO4、鞭炮引线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示在没有通风装置时制取并且收集氯气时设计的装置图,图中A、B是可控制的弹簧铁夹。

(1)烧杯中盛放的液体是_____,水槽中盛放的液体是______。
(2)写出制取氯气的化学方程式:____________________。
(3)将8.7gMnO2与含HCl的质量为14.6g的浓盐酸共热制Cl2,甲同学认为可制得Cl27.1g,乙同学认为制得Cl2的质量小于7.1g,你认为________(填“甲”或“乙”)同学正确,原因是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟及氟产品在工农业生产中应用非常广泛,回答下列问题:
(1)基态氟原子核外电子的运动状态有种,这些电子的电子云形状有种;氟原子的外围电子排布式为 .
(2)NaHF2(氟化氢钠)电解可制氟气,NaHF2中所含作用力的类型有;与HF2﹣互为等电子体的分子有(举一例).
(3)N2F2(二氟氮烯)分子中,氮原子的杂化轨道类型为 , 画出N2F2可能的结构式 .
(4)三氟化硼乙醚(如图1)的熔点为﹣58℃,沸点为126~129℃,它属于晶体.
(5)氟化钙的晶胞结构如图2所示,晶胞参数α=0.555pm. ①Ca2+、F﹣的配位数分别为和 .
②列式表示氟化钙晶体的密度:gcm﹣3(不必计算出结果).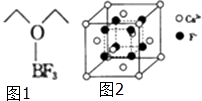
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如下图所示。下列说法正确的是 ( )
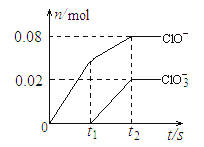
A. 苛性钾溶液中KOH的质量是5.6 g B. 反应中转移电子的物质的量是0.18mol
C. 在酸性条件下 ClO- 和ClO3-可生成Cl2 D. 一定有3.136 L氯气参与反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸是一种重要的化工原料,常用于有机合成,它属于二元弱酸,易溶于乙醇、水、微溶于乙醚.以甘蔗碎渣(主要成分为纤维素)为原料制取草酸的工艺流程如下: 已知:NO2+NO+2NaOH═2NaNO2+2H2O,2NO2+2NaOH═2NaNO2+H2O.
回答下列问题:
(1)步骤①水解液中所含主要有机物为(写结构简式),浸取时要想提高水解速率除可减小甘蔗碎渣粒度外,还可采取的措施是;浸取时硫酸浓度不宜过高,其原因是 .
(2)步骤②会生成草酸,硝酸的还原产物为NO2和NO且n(NO2):n(NO)=3:1,则反应的离子方程式为 , 生成的NO2及NO若被NaOH溶液完全吸收,则产物中的两种盐n(NaNO2):n(NaNO3)= .
(3)步骤③的主要目的是 .
(4)设计步骤⑦和⑧的目的分别是、 .
(5)为了确定产品中H2C2O42H2O的纯度,称取10.5g草酸样品,配成250mL溶液,每次实验时准确量取20.00mL草酸溶液,加入适量的稀硫酸,用0.10molL﹣1的KMO4标准溶液滴定.平行滴定三次,消耗KMO4标准溶液的体积平均为26.00mL.则产品中H2C2O42H2O的质量分数为 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,两种气体的体积如果不同,其主要原因是 ( )
A. 气体的分子大小不同
B. 气体分子间的平均距离不同
C. 气体的物质的量不同
D. 气体的性质不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于铜电极的叙述中正确的是( )
A.铜锌原电池中铜是负极
B.用电解法精炼粗铜时粗铜作阳极
C.在铁上电镀铜时用铜作阴极
D.电解稀硫酸时用铜作阳极,阳极产生氧气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用98%的浓H2SO4(ρ=1.84g/cm3)配制250ml 0.5mol/L的稀H2SO4的操作简单可概括为计算、称量、溶解、移液、洗涤、定容、摇匀、装瓶.请按要求填空:
(1)所需浓H2SO4的体积为 .
(2)如果实验室有10mL、20mL、50mL量筒,应选用mL量筒最好.量取时发现量筒不干净,用水洗净后直接量取,所配溶液浓度将(偏高、偏低、无影响).
(3)除量筒和胶头滴管外还需用到的玻璃仪器有: .
(4)洗涤操作一般要求重复次,且洗涤液均要 .
(5)定容的操作为:向容量瓶中加入蒸馏水,至液面离刻度线处,改用胶头滴管滴加,至 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com