
| H2CO3 | H2C2O4 | HNO2 | HClO |
| K1=4.4×10-7 K2=4.7×10-11 | K1=5.4×10-2 K2=5.3×10-5 | K=7.2×10-4 | K=2.9×10-8 |
分析 I.(1)由CO、H2、CH3OH(g)的燃烧热可得热化学方程式:
①CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0kJ•mol-1
②H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ•mol-1
③CH3OH(g)+$\frac{3}{2}$O2(g)=CO2(g)+2 H2O(l)△H=-764.5kJ•mol-1
由盖斯定律可知,①+2×②-③可得CO(g)+2H2(g)?CH3OH(g);
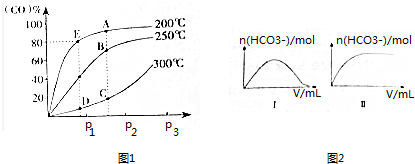
(2)①A点温度低于B点,该反应为放热反应,升高温度,平衡向逆反应方向移动;
②该反应为有气体参与的反应,增大压强,反应速率越快;
③E点CO转化率为80%,计算平衡时各组分浓度,再根据K=$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$计算平衡常数;若使v正>v逆,反应正向进行,则浓度商Qc<K;
Ⅱ.(3)A.正反应为放热反应,升高温度,平衡逆向移动;
B.再充入1molCH3OH(g)和1molH2O(g),等效为在原平衡基础上增大压强;
C.加入催化剂不影响平衡移动;
D.$\frac{n(C{H}_{3}OH)}{n(C{O}_{2})}$=K×$\frac{{c}^{3}({H}_{2})}{c({H}_{2}O)}$,再充入一定量CO2,平衡正向移动,氢气浓度减小、水蒸气浓度增大;
(4)由电离平衡常数可知,酸性:H2C2O4>HNO2>HC2O4->HClO>HCO3-,根据强酸制备弱酸,可知H2C2O4、HNO2能与碳酸钠反应生成二氧化碳,而HClO与碳酸钠反应只能得到碳酸氢钠.
解答 解:I.(1)由CO、H2、CH3OH(g)的燃烧热可得热化学方程式:
①CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0kJ•mol-1
②H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ•mol-1
③CH3OH(g)+$\frac{3}{2}$O2(g)=CO2(g)+2 H2O(l)△H=-764.5kJ•mol-1
由盖斯定律可知,①+2×②-③可得CO(g)+2H2(g)?CH3OH(g),故△H=-283.0kJ•mol-1+2×(-285.8kJ•mol-1 )-(-764.5kJ•mol-1 )=-90.1kJ•mol-1,
故答案为:-90.1kJ•mol-1;
(2)①A点温度低于B点,该反应为放热反应,升高温度,平衡向逆反应方向移动,故CH3OH的质量分数ω(A)>ω(B),
故答案为:>;A点温度低于B点,该反应为放热反应,升高温度,平衡向逆反应方向移动;
②该反应为有气体参与的反应,C点压强大于D点,增大压强,反应速率越快,逆反应速率:v正(C)>v逆(D),
故答案为:>;该反应为有气体参与的反应,C点压强大于D点,增大压强,反应速率越快;
③E点CO转化率为80%,转化的CO为0.8mol,则:
CO(g)+2H2(g)?CH3OH(g)
起始量(mol):1 2 0
变化量(mol):0.8 1.6 0.8
平衡量(mol):0.2 0.4 0.8
容器体积为10L,则平衡常数K=$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$=$\frac{\frac{0.8}{10}}{\frac{0.2}{10}×(\frac{0.4}{10})^{2}}$=2500,
保持温度和容积不变,再向容器中充入1molCO、1molH2和xmolCH3OH时,若使v正>v逆,反应正向进行,则浓度商Qc=$\frac{\frac{0.8+x}{10}}{\frac{1+0.2}{10}×(\frac{1+0.4}{10})^{2}}$<2500,解得x<58,故0<x<58
故答案为:2500;0<x<58;
Ⅱ.(3)A.正反应为放热反应,升高温度,平衡逆向移动,$\frac{n(C{H}_{3}OH)}{n(C{O}_{2})}$减小,故A错误;
B.再充入1molCH3OH(g)和1molH2O(g),等效为在原平衡基础上增大压强,平衡正向移动,$\frac{n(C{H}_{3}OH)}{n(C{O}_{2})}$增大,故B正确;
C.加入催化剂可以加快反应速率,不影响平衡移动,$\frac{n(C{H}_{3}OH)}{n(C{O}_{2})}$不变,故C错误;
D.$\frac{n(C{H}_{3}OH)}{n(C{O}_{2})}$=K×$\frac{{c}^{3}({H}_{2})}{c({H}_{2}O)}$,再充入一定量CO2,平衡正向移动,氢气浓度减小、水蒸气浓度增大,$\frac{n(C{H}_{3}OH)}{n(C{O}_{2})}$减小,故D错误,
故选:B;
(4)由电离平衡常数可知,酸性:H2C2O4>HNO2>HC2O4->HClO>HCO3-,根据强酸制备弱酸,可知H2C2O4、HNO2能与碳酸钠反应生成二氧化碳,开始加入的酸较小,反应生成碳酸氢盐,溶液中碳酸氢根增大,全部转化为碳酸氢钠时,再滴加酸又转化为二氧化碳,符合曲线Ⅰ,而HClO与碳酸钠反应只能得到碳酸氢钠,符合曲线Ⅱ,
故答案为:①②;③.
点评 本题考查比较综合,涉及反应热计算、化学平衡图象与影响因素、平衡常数计算及应用、电离平衡常数等,侧重考查学生信息获取与知识迁移运用,难度中等.


 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 1:2 | B. | 2:5 | C. | 1:10 | D. | 1:8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室可用环己醇(沸点:160.84℃,微溶于水)制备环己酮(沸点:155.6℃,微溶于水),使用的氧化剂可以是次氯酸钠、重铬酸钾等.
实验室可用环己醇(沸点:160.84℃,微溶于水)制备环己酮(沸点:155.6℃,微溶于水),使用的氧化剂可以是次氯酸钠、重铬酸钾等.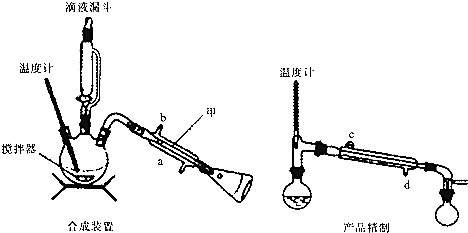
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能使甲基橙变红的溶液中:Na+、K+、SO${\;}_{4}^{2-}$、AlO${\;}_{2}^{-}$ | |
| B. | $\frac{{K}_{W}}{c({H}^{+})}$=1×10-12mol•L-1的澄清溶液中:Cu2+、Mg2+、SO42-、NO${\;}_{3}^{-}$ | |
| C. | 0.1mol•L-1FeCl2溶液中:Al+、Ca2+、SCN-、ClO- | |
| D. | 水电离的c(H+)=1×10-13mol•L-1的溶液中:K+、NH${\;}_{4}^{+}$、NO${\;}_{3}^{-}$、CO${\;}_{3}^{2-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Al>Mg>Na | B. | 热稳定性:HF>H2O>NH3 | ||
| C. | 酸性:HClO4>H2SO4>H2PO4 | D. | 金属性:Na>Mg>Al |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化铝可以与氢氧化钠溶液反应 | |
| B. | 向硅酸钠溶液中滴加适量稀盐酸,有透明的凝胶形成 | |
| C. | 氯气通入石蕊中先变红后褪色 | |
| D. | 向Fe2(SO4)3溶液中滴加NaOH溶液,生成红褐色沉淀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com