
| A. | H2O | B. | HCl | C. | NH4Cl | D. | CO2 |
分析 活泼金属和活泼非金属元素之间易形成离子键,铵根离子和酸根离子之间易形成离子键,非金属元素之间易形成共价键,含有离子键的化合物是离子化合物,离子化合物中可能含有共价键,只含共价键的化合物是共价化合物,据此分析解答.
解答 解:A.水分子中H-O原子之间只存在共价键,为共价化合物,故A错误;
B.HCl分子中H-Cl原子之间只存在共价键,为共价化合物,故B错误;
C.氯化铵中铵根离子和氯离子之间存在离子键、N-H原子之间存在共价键,为离子化合物,故C正确;
D.二氧化碳分子中C-O原子之间只存在共价键,为共价化合物,故D错误;
故选C.
点评 本题考查离子化合物和共价化合物判断,为高频考点,明确物质构成微粒及微粒之间作用力是解本题关键,注意不能关键是否含有金属元素判断离子键,易错选项是C.


 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案科目:高中化学 来源: 题型:选择题
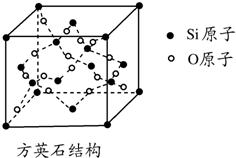 二氧化硅有晶体和无定形两种形态,晶态二氧化硅主要存在于石英矿中.除石英外,SiO2还有磷石英和方英石等多种变体.方英石结构和金刚石相似,其结构单元如图.下列有关说法正确的是( )
二氧化硅有晶体和无定形两种形态,晶态二氧化硅主要存在于石英矿中.除石英外,SiO2还有磷石英和方英石等多种变体.方英石结构和金刚石相似,其结构单元如图.下列有关说法正确的是( )| A. | 方英石晶体中存在着SiO4结构单元 | |
| B. | 1 mol Si形成2 mol Si-O键 | |
| C. | 上图所示的结构单元中实际占有18个硅原子 | |
| D. | 方英石晶体中,Si-O键之间的夹角为90° |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Mn、Fe均为第四周期过渡元素,部分电离能数据如表所示,请回答下列问题:
Mn、Fe均为第四周期过渡元素,部分电离能数据如表所示,请回答下列问题:| 元素 | Mn | Fe | |
| 电离能(kJ•mol-1) | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸、纯碱、氯化钠 | B. | 硝酸、生石灰、硫酸钡 | ||
| C. | 盐酸、熟石灰、石英 | D. | 硫酸、烧碱、碳酸氢钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 28gFe与0.5 molCl2充分反应转移电子数为1.5NA | |
| B. | 常温常压下,19 g D3O+含有10 NA个电子 | |
| C. | 室温时,0.1 mol/L Na2CO3溶液中所含Na+数为0.2NA | |
| D. | 25℃时,1 L pH=12的Ba(OH)2溶液中含有的OH-的数目为0.01 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
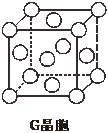 现有前四周期六种元素X、Y、Z、E、F、G,它们的原子序数依次增大,除G外,其它五种元素都是短周期元素.X、Y、E三种元素组成的化合物是实验室常用燃料.取F的化合物做焰色反应实验,其焰色呈黄色,G的单质是生活中常见的一种金属,GE是黑色固体.请回答下列问题:
现有前四周期六种元素X、Y、Z、E、F、G,它们的原子序数依次增大,除G外,其它五种元素都是短周期元素.X、Y、E三种元素组成的化合物是实验室常用燃料.取F的化合物做焰色反应实验,其焰色呈黄色,G的单质是生活中常见的一种金属,GE是黑色固体.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可用湿润的淀粉碘化钾试纸检验产物Q | |
| B. | K2FeO4在水中的电离方程式为K2FeO4→2K++Fe6++4O2一 | |
| C. | 反应中氧化剂与还原剂的物质的量之比为1:3 | |
| D. | 反应中涉及的物质中有5种为电解质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com