
开发、使用清洁能源发展“低碳经济”,正成为科学家研究的主要课题。氢气、甲醇是优质的清洁燃料,可制作燃料电池。
(1)已知:①2CH3OH(1)+ 3O2(g)= 2CO2(g)+ 4H2O(g)ΔH1 = –1275.6 kJ·mol– 1
②2CO(g)+ O2(g)= 2CO2(g) ΔH2 = –566.0 kJ·mol– 1
③H2O(g)= H2O(1) ΔH3 = –44.0 kJ·mol– 1写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式: 。
(2)生产甲醇的原料CO和H2来源于:CH4(g)+ H2O(g) CO(g)+ 3H2(g)
CO(g)+ 3H2(g)
① 一定条件下CH4的平衡转化率与温度、压强的关系如图a。则,Pl P2;A、B、C三点处对应平衡常数(KA、KB、KC)的大小顺序为__________。(填“<”、“>”“=”)

② 100℃时,将1 mol CH4和2 mol H2O通入容积为100 L的反应室,反应达平衡的标志是: 。
a.容器内气体密度恒定
b.单位时间内消耗0.1 mol CH4同时生成0.3 mol H2
c.容器的压强恒定
d.3v正(CH4)= v逆(H2)如果达到平衡时CH4的转化率为0.5,则100℃时该反应的平衡常数K =
(3)某实验小组利用CO(g)、O2(g)、KOH(aq)设计成如图b所示的电池装置,负极的电极反应式为 。用该原电池做电源,常温下,用惰性电极电解200 mL饱和食盐水(足量),消耗的标准状况下的CO 224 mL,则溶液的pH = 。(不考虑溶液体积的变化)
(4)氢氧燃料电池的三大优点是: 、 、能连续工作。
科目:高中化学 来源: 题型:
如图,烧杯中试管内有一枚铁钉,放置数天观察:
(1)铁钉在逐渐生锈,则铁钉的腐蚀属于 腐蚀。(2)若试管内液面上升 ,则原溶液呈 ,发生 腐蚀,电极反应:负极 ;正极 。
,则原溶液呈 ,发生 腐蚀,电极反应:负极 ;正极 。
(3)若试管内液面下降,则原溶液呈 性,电极反应:负极 ;正极 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是 ( )。
A.乙醇和汽油都是可再生能源,应大力推 广“乙醇汽油”
广“乙醇汽油”
B.钢铁在 海水中比在河水中更易腐蚀,主要原因是海水中含氧量高于河水
海水中比在河水中更易腐蚀,主要原因是海水中含氧量高于河水
C.废弃的塑料、金属、纸制品及玻璃都是可回收再利用的资源
D.凡含有食品添加剂的食物对人体健康均有害,不宜食用
查看答案和解析>>
科目:高中化学 来源: 题型:
已知在25℃的水溶液中,AgX、AgY、AgZ均难溶于水,但存在溶解平衡。当达到平衡时,溶液中离子浓度的乘积是一个常数(此常数用Ksp表示,Ksp和水的Kw相似)。如
AgX(s) Ag+(aq)+X-(aq),Ksp(AgX)=c(Ag+)·c(X-)=1.8×10-10
Ag+(aq)+X-(aq),Ksp(AgX)=c(Ag+)·c(X-)=1.8×10-10
AgY(s) Ag+(aq)+Y-(aq),Ksp(AgY)=c(Ag+)·c(Y-)=1.0×10-12
Ag+(aq)+Y-(aq),Ksp(AgY)=c(Ag+)·c(Y-)=1.0×10-12
AgZ(s) Ag+(aq)+Z-(aq),Ksp(AgZ)=c(Ag+)·c(Z-)=8.7×10-17
Ag+(aq)+Z-(aq),Ksp(AgZ)=c(Ag+)·c(Z-)=8.7×10-17
下列说法错误的是( )
A.这三种物质在常温下溶解度最小的是AgZ
B.将AgY溶解于水后,向其中加入AgX,则c(Y-)减小
C.在25℃时,取0.188 g AgY(相对分子质量为188)固体放入100 mL水中(忽略溶液体积的变化),则溶液中c(Y-)=1.0×10-4mol·L-1
D.沉淀溶解平衡的建立是有条件的,外界条件改变时,平衡也会发生移动
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验能达到预期目的的是 ( )
A.将含有SO2的CO2气体通过足量的饱和Na2CO3溶液以除去SO2
B.称取19.0g氯化亚锡(SnCl2),用100mL蒸馏水溶解,配制1.0mol/LSnCl2溶液
C.用石墨作电极,电解Mg(NO3)2、Cu(NO3)2的混合溶液,确定铜和镁的金属活动性强弱
D.测定NaCl和NaF溶液的pH值,确定F、Cl两元素非金属性的强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
随着科学技术的不断进步,研究物质的手段和途径越来越多,N5+、H3、O4、C60等已被发现。下列有关说法中,正确的是
A.N5+ 离子中含有36个电子 B.H2与H3属于同素异形体
C.C60的摩尔质量为720 D.O2与O4属于同位素
查看答案和解析>>
科目:高中化学 来源: 题型:
明矾石的主要成分是K2SO4·Al2(SO4)3·2Al 2O3·6H2O,此外还含有少量Fe2O3杂质。利用明矾石来制取纯净的Al2O3、K2FeO4和H2SO4的工艺流程如图所示:
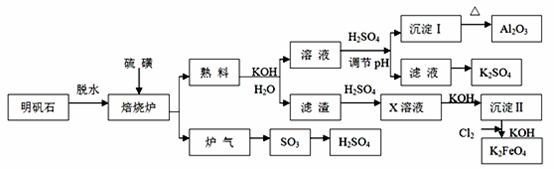
(1)“焙烧”过程中Al2(SO4)3和S发生反应的化学方程式为 ;
若生成102g Al2O3,转移的电子数目为 ;
(2)生成沉淀Ⅰ时的离子方程式为 ;
(3)写出化学式:沉淀Ⅱ是 ;
(4)溶液经加硫酸调节pH后,过滤,洗涤,可得沉淀Ⅰ,证明沉淀Ⅰ已洗涤干净的实验操作和现象是 ;
(5)从滤液中得到K2SO4晶体的方法是 ;
(6)K2FeO4也可以铁为电极,通过电解浓的KOH溶液来制取,写出电解法制取K2FeO4的阳极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E、F分别是氧化铁、二氧化碳、稀盐酸、氢氧化钙溶液、碳酸钠溶液、氢氧化钠溶液中的一种;已知C在日常生活中常用来灭火。六种物质之间有如图所示的反应关系,图中相连的两圆表示相应物质间能发生反应。回答下列问题:

(1)E与F反应的实验现象是 ________________。
(2)A与D反应的化学方程式为 ____________。
(3)B能转化成A,反应的化学方程式为 _________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ、一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g) FeO(s)+CO(g) ΔH>0。
FeO(s)+CO(g) ΔH>0。
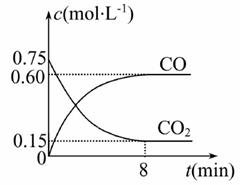
(1)下列措施中能使平衡时c(CO)/c(CO2)增大的是_________(填序号)。
A.升高温度 B.增大压强
C.充入一定量氮气 D.再加入一些铁粉
(2)反应达到平衡后,若保持容器体积不变时,再通入一定量的CO2,使CO2的浓度成为原来的2倍,则CO2的转化率将_______(填“增大”“减小”或“不变”)。
Ⅱ、在一定温度下的某容积可变的密闭容器中,建立下列化学平衡:C(s)+H2O(g) CO(g)+H2(g),试分析和回答下列问题:
CO(g)+H2(g),试分析和回答下列问题:
(1)可认定上述可逆反应在一定条件下已达到化学平衡状态的是______(选填序号)。
A.体系的压强不再发生变化
B.v正(CO)=v逆(H2O)
C.生成n mol CO的同时生成n mol H2
D.1 mol H—H键断裂的同时断裂2 mol H—O键
(2)若上述化学平衡状态从正反应开始建立,达到平衡后,给平衡体系加压(缩小容积、其他条件不变),则容器内气体的平均相对分子质量将______(填写“不变”“变小”或“变大”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com