
| 化学式 | 电离常数(25℃) |
| CH3COOH | Ki =1.7×10-5 |
| HClO | Ki =3.0×10-8 |
| H2CO3 | Ki1=4.3×10-7 Ki2=5.6×10-11 |
 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源:不详 题型:单选题
| 选项 | 离子或分子 | 要求 |
| A | K+、NO3-、Cl-、HS- | c(K+) > c(Cl-) |
| B | Fe3+、MnO4?、SO32-、Cl- | 滴加盐酸立即有气体产生 |
| C | NH4+、Al3+、SO42-、CH3COOH | 滴加NaOH溶液立即有气体产生 |
| D | Na+、HCO3-、Ca2+、I- | 通CO2气体有沉淀产生 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.K+、Ca2+、CO32- | B.H+、NH4+、SO42- |
| C.H+、Cl-、HCO3- | D.Fe3+、SO42-、SCN- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①③④ | B.②④⑤ | C.②③⑤ | D.②③④⑤ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.由水电离的c(H+)=1×l0-14mol/L的溶液中:Ca2+、K+、Cl-、HCO3- |
| B.pH=1的溶液中:K+、Cr2O72-、SO42-、CH3CHO |
| C.加石蕊呈蓝色的溶液中:Na+、K+、AlO2-、NO3- |
| D.通入足量CO2后的溶液中:NH4+、Na+、C6H5O-、Cl- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.镁与极稀硝酸反应生成硝酸铵的离子方程式为:4Mg+6H++NO3- =4Mg2++NH4++3H2O |
| B.25℃时,将20 mL 0.1mol·L-1H2SO4溶液和30 mL 0.15mol·L-1NaOH溶液混合,若混合后溶液体积不变,则混合溶液的pH为11 |
| C.将10 mL 0.1 mol·L-1KAl(SO4)2溶液和10 mL0.2 mol·L-1Ba(OH)2溶液混合,得到的沉淀中Al(OH)3和BaSO4的物质的量之比为1:2 |
| D.浓度均为0.1 mol·L-1的醋酸和CH3COONa溶液等体积混合,溶液中有下列关系:c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.将SO2通入酸性高锰酸钾溶液中,溶液褪色,说明SO2具有漂白性 |
| B.相同温度下,完全中和相同PH、相同体积的氨水和NaOH溶液,所需相同浓度的盐酸体积相等 |
| C.0.1mol·L-1的酸式盐NaHA溶液中,c(Na+)=0.1mol·L-1≥c(A2-) |
D.向KI溶液中加入氯化银,沉淀逐渐变黄色,说明同温下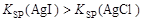 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.②和④混合,所得混合溶液的pH大于7 |
| B.将四种溶液分别稀释到体积为原的100倍,溶液pH大小顺序③>④>②>① |
| C.③和④分别与足量稀硫酸中和,消耗硫酸的体积③=④ |
| D.①和③混合,所得混合溶液中c(H+)+ c(NH4+)=c(Cl-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题


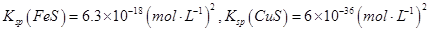
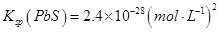
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com