
| A. | “静电除尘”、“汽车尾气的催化净化”都有利于提高空气的质量 | |
| B. | 减少化石燃料的使用,有利于降低空气中PM2.5的含量 | |
| C. | 石油的分馏是获得芳香烃的主要途径 | |
| D. | 医用酒精是用淀粉类植物发酵经蒸馏、加工制成,浓度通常是75% |
分析 A.“静电除尘”除去可吸入颗粒物,“汽车尾气的催化净化”除去污染物;
B.PM2.5中的气体污染物主要是化石燃料燃烧的产物;
C.石油的催化重整是获得芳香烃的主要来源;
D.淀粉类植物发酵经蒸馏得到乙醇,医用酒精的体积分数75%.
解答 解:A.“静电除尘”除去可吸入颗粒物,“汽车尾气的催化净化”除去污染物,都有利于提高空气的质量,故A正确;
B.PM2.5中的气体污染物主要是化石燃料燃烧的产物,所以减少化石燃料的使用,有利于降低空气中PM2.5的含量,故B正确;
C.石油的催化重整是获得芳香烃的主要来源,故C错误;
D.医用酒精是用淀粉类植物发酵经蒸馏制成,体积分数通常是75%,故D正确;
故选:C.
点评 本题主要考查了空气污染和石油的炼制等知识,难度不大,注意知识的积累.


 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y2-的离子半径大于W3+的离子半径 | |
| B. | Y、Z形成的化合物为离子化合物 | |
| C. | Z的最高价氧化物对应的水化物的酸性比X的强 | |
| D. | X的气态简单氢化物的稳定性比Y的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生物炼铜比高温炼铜更清洁、成本更低 | |
| B. | 光分解水制氢气、植物秸秆制沼气、高粱制乙醇都涉及到生物质能的利用 | |
| C. | 用福尔马林灭活埃博拉病毒是利用了蛋白质变性原理 | |
| D. | 扫描隧道显微技术、超分辨率荧光显微技术等技术的发展促进了人类对物质微观结构的探索,使科学研究迈入更高水平层次 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
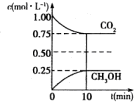 (1)二氧化碳是引起“温室效应”的主要物质,节能减排,高效利用能源,能够减少二氧化碳的排放.在一定温度下的2L固定容积的密闭容器中,通入2molCO2和3molH2,发生的反应为CO2(g)+3H2(g) CH3OH(g)+H2O(g),△H=-aKJ•mol-1(a>0),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示.
(1)二氧化碳是引起“温室效应”的主要物质,节能减排,高效利用能源,能够减少二氧化碳的排放.在一定温度下的2L固定容积的密闭容器中,通入2molCO2和3molH2,发生的反应为CO2(g)+3H2(g) CH3OH(g)+H2O(g),△H=-aKJ•mol-1(a>0),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2O | B. | NO | C. | N2O5 | D. | NO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
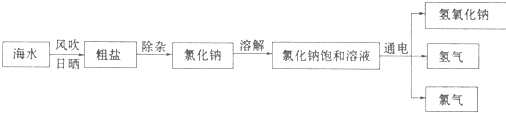
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生石灰-Ca(OH)2 | B. | 醋酸-C2H4O2 | C. | 石膏-2CaSO4•H2O | D. | 小苏打-KHCO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com