
某温度下,向一定体积0.1 mol·L-1的醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH(pOH=-lg[OH-])与pH的变化关系如图所示,则( )
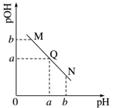
A.M点所示溶液的导电能力强于Q点
B.N点所示溶液中c(CH3COO-)>c(Na+)
C.M点和N点所示溶液中水的电离程度相同
D.Q点消耗NaOH溶液的体积等于醋酸溶液的体积
答案 C
解析 结合醋酸与NaOH溶液的反应,pOH、pH的定义及题给图像,分析各选项并得出合理答案。
Q点pOH=pH=a,则有c(H+)=c(OH-),此时溶液呈中性,那么c(CH3COO-)=c(Na+),N点溶液呈碱性,c(OH-)>c(H+),那么c(CH3COO-)<c(Na+),B错;结合图像可知,M点溶液中含有CH3COOH和CH3COONa,在滴加NaOH溶液的过程中,溶液中离子浓度变大,则M点溶液的导电能力比Q点弱,A错;M点pOH=b,N点pH=b,说明M点c(OH-)与N点c(H+)相等,对水的电离抑制程度相同,因此M点和N点水的电离程度相同,C对;若消耗NaOH溶液与醋酸溶液的体积相等,二者恰好反应生成CH3COONa,溶液显碱性,而Q点溶液呈中性,显然醋酸溶液的体积大于消耗NaOH溶液的体积,D错。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
处于前三周期的主族元素A、B、C、D,其离子半径逐渐增大,它们的原子中核外都有一个未成对电子。已知A和D处于同一周期,0.2 mol A单质可以从D的氢化物的水溶液中置换出6.72 L H2(标准状况),试回答:
(1)写出元素符号:
A.________,B.________,C.________,D.________;
(2)若C有气态氢化物存在,比较C和D的氢化物:
沸点__________,稳定性__________,水溶液的酸性____________;
(3)四种元素的第一电离能由大到小的排列顺序是________________________;
(4)四种元素的电负性由小到大的顺序是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
硫酸镍铵[(NH4)xNiy(SO4)m·nH2O]可用于电镀、印刷等领域。某同学为测定硫酸镍铵的组成,进行如下实验:①准确称取2.335 0 g样品,配制成100.00 mL溶液A;②准确量取25.00 mL溶液A,用0.040 00 mol·L-1的EDTA(Na2H2Y)标准溶液滴定其中的Ni2+(离子方程式为Ni2++H2Y2-===NiY2-+2H+),消耗EDTA标准溶液31.25 mL;③另取25.00 mL溶液A,加足量的NaOH溶液并充分加热,生成NH3 56.00 mL(标准状况)。
(1)若滴定管在使用前未用EDTA标准溶液润洗,测得的Ni2+含量将________(填“偏高”、“偏低”或“不变”)。
(2)氨气常用________检验,现象是______________________________________________。
(3)通过计算确定硫酸镍铵的化学式(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
某小组以CoCl2·6H2O、NH4Cl、H2O2、浓氨水为原料,在活性炭催化下,合成了橙黄色晶体X,为确定其组成,进行如下实验。
①氨的测定:精确称取w g X,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量10% NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,用V1 mL c1 mol·L-1的盐酸标准溶液吸收。蒸氨结束后取下接收瓶,用c2 mol·L-1 NaOH标准溶液滴定过剩的HCl,到终点时消耗V2 mL NaOH溶液。
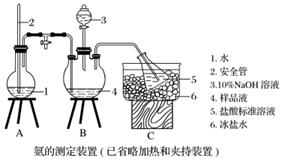
②氯的测定:准确称取样品X,配成溶液后用AgNO3标准溶液滴定,K2CrO4溶液为指示剂,至出现淡红色沉淀不再消失为终点(Ag2CrO4为砖红色)。
回答下列问题:
(1)装置中安全管的作用原理是_____________________________________________
________________________________________________________________________。
(2)用NaOH标准溶液滴定过剩的HCl时,应使用______式滴定管,可使用的指示剂为________。
(3)样品中氨的质量分数表达式为________________。
(4)测定氨前应该对装置进行气密性检验,若气密性不好测定结果将________(填“偏高”或“偏低”)。
(5)测定氯的过程中,使用棕色滴定管的原因是_____________________________________;滴定终点时,若溶液中c(Ag+)=2.0×10-5 mol·L-1,c(CrO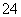 )为________ mol·L-1。[已知:Ksp(Ag2CrO4)=1.12×10-12]
)为________ mol·L-1。[已知:Ksp(Ag2CrO4)=1.12×10-12]
(6)经测定,样品X中钴、氨和氯的物质的量之比为1∶6∶3,钴的化合价为________。制备X的化学方程式为______________________________________________________
________________________________________________________________________;
X的制备过程中温度不能过高的原因是____________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
现有部分被氧化的钠样品10 g,将其投入水中充分反应,将所得溶液稀释成400 mL,若实验测得该钠样品中含有8%的氧元素,则常温下所得溶液的pH为( )
A.14 B.13 C.12 D.无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
已知下列热化学方程式:
①H2(g)+1/2O2(g)===H2O(g) ΔH1=a kJ·mol-1
②2H2(g)+O2(g)===2H2O(g) ΔH2=b kJ·mol-1
③H2(g)+1/2O2(g)===H2O(l) ΔH3=c kJ·mol-1
④2H2(g)+O2(g)===2H2O(l) ΔH4=d kJ·mol-1
下列关系式中正确的是( )
A.a<c<0 B.b>d>0
C.2a=b<0 D.2c=d>0
查看答案和解析>>
科目:高中化学 来源: 题型:
把NaHCO3和NaOH的混合物放在密闭容器中加热,下列关于混合物加热前后消耗盐酸的物质的量的判断正确的是( )
A.加热前消耗得多
B.加热后消耗得多
C.加热前后一样多
D.当NaOH适量时才会一样多
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com