
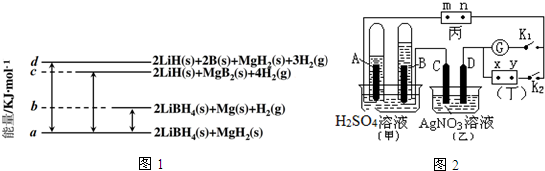
分析 (1)根据反应热的意义,由图可知:
2LiBH4(s)=2LiH(s)+2B(s)+3H2(g)△H=+(d-a) kJ•mol-1①
MgH2(s)=Mg(s))+H2(g)△H=+(b-a)kJ•mol-1②
2LiBH4(s)+MgH2(s)=2LiH(s)+MgB2(s)+4H2(g)△H=+(c-a) kJ•mol-1③
应用盖斯定律计算化学反应的焓变;
(2)原电池负极发生氧化反应,甲醚在负极放电,碱性条件下生成碳酸根与水,原电池反应比直接燃烧能量转化率高;二甲醚与乙醇的结构不同,所以含有的共价键的种类不同,断键时吸收的能量不同;
(3)闭合K2,断开K1时,该甲、乙、丙为电解装置,据电解硫酸溶液时生成氢气和氧气的体积可以判断电源的正负极;电解KI溶液时,据离子的放电顺序书写电解方程式;甲池中A、B极均部分被气体包围时,断开K2,闭合K1,甲为原电池乙为电解池,据此分析.
解答 解:(1)由图可知:
2LiBH4(s)=2LiH(s)+2B(s)+3H2(g)△H=+(d-a) kJ•mol-1①
MgH2(s)=Mg(s))+H2(g)△H=+(b-a)kJ•mol-1②
2LiBH4(s)+MgH2(s)=2LiH(s)+MgB2(s)+4H2(g)△H=+(c-a) kJ•mol-1③
据盖斯定律③-①-②得:Mg(s)+2B(s)═MgB2(s)△H=+(a+c-b-d)kJ•mol-1
故答案为:(a+c-b-d) kJ•mol-1;
(2)原电池负极发生氧化反应,甲醚在负极放电,碱性条件下生成碳酸根与水,电极反应式为:CH3OCH3+16OH--12e-=2CO32-+11H2O,
两种燃料所含共价键数目相同,但是共价键种类不同,所以断键时所需能量不相同,所以燃烧热不同,比能量不相同,但正极上都是氧气反应,电极反应式相同,所以ABC错误,D正确;故答案为:CH3OCH3+16OH-12e-=2CO2-3+11H2O;D;
(3)闭合K2,断开K1时,该甲、乙、丙为电解装置,据电解硫酸溶液时生成氢气和氧气的体积可以判断,A为阴极,氢离子在阴极放电生成氢气,B为阳极,氢氧根离子在阳极放电生成氧气,所以x为电源的正极;电解KI溶液时,碘离子和氢离子分别在两极放电,电解的离子方程式为2I-+2H2O $\frac{\underline{\;通电\;}}{\;}$I2+H2↑+2OH-;甲池中A、B极均部分被气体包围时,断开K2,闭合K1,甲为原电池乙为电解池,B电极是正极,氧气在正极反应,在酸性环境中反应的电极反应式为O2+4e-+4H+=2H2O,C电极为阳极,氢氧根离子在阳极放电生成氧气,电极反应式为4OH-+4e-=O2↑+2H2O,故答案为:正;2I-+2H2O $\frac{\underline{\;通电\;}}{\;}$I2+H2↑+2OH-;O2+4e-+4H+=2H2O;4OH-+4e-=O2↑+2H2O.
点评 本题考查了盖斯定律的应用、原电池原理阳极电极反应式书写、电解原理以及电极反应式书写,注意电解质溶液中离子的放电顺序,题目难度较大.


科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ①②③ | C. | ②③④ | D. | 只有② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ②③④ | C. | ③④ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性强弱:H2SiO3<H2CO3<HNO3 | B. | 原子半径大小:Na>S>O | ||
| C. | 碱性强弱:KOH>NaOH>LiOH | D. | 非金属性强弱:I>Cl>F |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3OH的燃烧热为192.9 kJ•mol-1 | |
| B. | 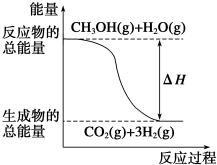 反应①中的能量变化如图所示 | |
| C. | CH3OH转变成H2的过程一定要吸收能量 | |
| D. | 根据②推知反应CH3OH(l)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g)的△H>-192.9 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验操作:制乙炔用饱和食盐水代替水,实验目的:加快化学反应速率 | |
| B. | 实验操作:C2H4与SO2混合气体通过盛有溴水的洗气瓶,实验目的:除去C2H4中的SO2 | |
| C. | 实验操作:淀粉溶液水解后冷却至温室,加碘水观察现象,实验目的:检验淀粉是否水解完全 | |
| D. | 实验操作:将溴乙烷与氢氧化钠水溶液共热一段时间,再向冷却后的混合液中滴加硝酸银溶液,实验目的:检验溴乙烷中的溴原子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com