
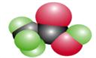
 如图是某烃的含氧衍生物的比例模型.该有机物是( )
如图是某烃的含氧衍生物的比例模型.该有机物是( ) 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案科目:高中化学 来源: 题型:
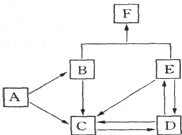 如图是某元素及其重要化合物之间的相互转化关系图(生成物中不含该元素的物质均已略去).其中A是单质,D在常温下呈气态,F可用作氮肥.
如图是某元素及其重要化合物之间的相互转化关系图(生成物中不含该元素的物质均已略去).其中A是单质,D在常温下呈气态,F可用作氮肥.
| ||
| △ |
| ||
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 净含量:500mL | |
| 饮用水矿物质成分(mg.L-1) | |
| 钙Ca | ≥4.0 |
| 镁Mg | ≥1.0 |
| 钠Na | ≥3.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 净含量500ml | |
| 饮用水矿物质成分(mg/L) | |
| 钙(Ca) | ≥4.0 |
| 镁(Mg) | ≥1.0 |
| 钠(Na) | ≥3.0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com