
【题目】做焰色反应实验时所用的铂丝,每次用毕后都要
A.用水多洗几次
B.先用稀盐酸洗,再用水洗
C.用稀盐酸洗,再在火焰上灼烧到没有什么颜色为止
D.放在火焰上灼烧,直到铂丝发红为止
 优等生题库系列答案
优等生题库系列答案科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2,黄绿色易溶于水的气体)是一种安全稳定、高效低毒的消毒剂。工业上通过惰性电极电解氯化铵和盐酸的方法制备,其原理如图所示:

下列说法不正确的是
A. b电极接电源的负极,在b极区流出的Y溶液是稀盐酸
B. 二氧化氯发生器中排出的X溶液中溶质主要为NaCl和NaOH
C. 电解过程中二氧化氯发生器中产生2.24L(标准状况)NH3,则b极产生0.6gH2
D. 电解池a极的电极反应式为NH4+-6e-+4OH-+3Cl-=NCl3+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五种短周期主族元素 W、M、X、Y、Z 原子序数依次增大,请结合表中信息回答下列问题:
元素 | W | M | X | Y | Z |
结构或性质 | 最高价含氧 酸与其气态 氢化物能发 生化合反应 | 氢化物的水 溶液能刻蚀 玻璃 | 焰色反应火 焰呈黄色 | 同周期主族元 素形成的简单 离子中,其离子 半径最小 | 最高正价与 最低负价代 数和为 6 |
(1)M元素在周期表中的位置为_____。
(2)M、X、Z元素所对应简单离子半径由大到小的顺序为_____________________(用离子符号表示)。
(3)W最高价含氧酸与其气态氢化物发生化合反应生成的物质中含有的化学键类型为___________________________________。
(4)下列可作为比较M和Z的非金属性强弱的依据是_________(填序号)。
A.单质与H2反应的难易程度
B.氢化物的稳定性
C.最高价氧化物的水化物酸性强弱
D.将M的单质通入Z的钠盐溶液观察是否有Z逸出
(5)W能形成多种氢化物,其中一种氢化物可作为火箭燃料,该物质中W与氢元素的质量比为7:1,写出该氢化物的电子式______。该氢化物和 O2 在碱性条件下可形成燃料电池,产生两种无毒物质,写出其负极的电极反应式___________.
(6)Y元素和W元素形成的化合物YW一种新型无机材料,可与过量烧碱溶液反应产生使湿润的红色石蕊试纸变蓝的气体,写出有关的化学方程式_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A. 向明矾溶液中加入过量氢氧化钡溶液:SO42-+Ba2+ ![]() BaSO4↓
BaSO4↓
B. 向CH3COOH中加入足量的氢氧化钠溶液: CH3COOH+OH- ![]() CH3COO-+H2O
CH3COO-+H2O
C. 向氢氧化亚铁中加入足量的稀硝酸:Fe(OH)2 +2H+![]() Fe2++2H2O
Fe2++2H2O
D. 向碳酸氢铵溶液中加入足量的氢氧化钠溶液:NH4++ OH- ![]() NH3·H2O
NH3·H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“一碳化学”是指以含一个碳原子的化合物(如:CO2、CO、CH4、CH3OH等)为初始反应物,合成一系列重要的化工原料和燃料的化学。以CO2和NH3为原料合成尿素是利用CO2的成功范例。在尿素合成塔中的主要反应可表示如下:
反应I:2NH3(g)+CO2(g)![]() NH2COONH4(s) △H1=-159.47kJ/mol K1
NH2COONH4(s) △H1=-159.47kJ/mol K1
反应II:NH2COONH4(s)![]() CO(NH2)2(s)+H2O(g) △H2=+72.49kJ/mol K2
CO(NH2)2(s)+H2O(g) △H2=+72.49kJ/mol K2
总反应:2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g) △H3 K3
CO(NH2)2(s)+H2O(g) △H3 K3
请回答:
(1)①总反应的△H3=_______kJ/mol。该热化学方程式的平衡常数K3=______(用K1、K2表示)。
②一定温度下,在体积固定的密闭容器中按计量比进行反应I,下列不能说明反应达平衡状态的是_____________。
A.混合气体的平均相对分子质量不再变化
B.容器内气体总压强不再变化
C.2V正(NH3)=V逆(CO2)
D.容器内混合气体的密度不再变化
③环境为真空时,在一敞开容器(非密闭容器)中加入NH2COONH4固体,足够长时间后,反应是否建立平衡状态? ___________(填“是”或“否”)。
(2)在体积可变的恒压 (P总) 密闭容器中充入1 mol CO2 与足量的碳,让其发生反应:C(s)+ CO2(g)![]() 2CO(g) △H>0。平衡时,体系中气体体积分数与温度的关系如下图所示。
2CO(g) △H>0。平衡时,体系中气体体积分数与温度的关系如下图所示。

①T℃时,达平衡后向容器中若充入稀有气体,v(正)___v(逆) (填“>”“<”或“=”);若充入等体积的CO2 和CO,平衡________移动(填“正向”“逆向”或“不”)。
②650℃,CO2 的转化率为_____________。
③已知:气体分压(P分)=气体总压×体积分数。用平衡分压代替平衡浓度表示平衡常数,925℃时,Kp=_____________ (用含P总的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子中,能在溶液中大量共存的是
A.H+、Ca2+、Cl-、CO32-B.I-、ClO-、K+、H+
C.Na+、Fe3+、SO42-、OH- D.Na+、Cu2+、Cl-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作不正确的是
A. 蒸发时,残留的少量水让余热蒸干
B. 分液时,下层液体从下端放出,上层液体从上端倒出
C. 蒸馏时,冷水从冷凝管上口进下口出
D. 过滤时,漏斗下端紧贴烧杯内壁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L密闭容器内,800℃时反应:2NO(g)+O2(g)![]() 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.01. | 0.008 | 0.007 | 0.007 | 0.007 |
(1)已知:K300℃>K350℃,写出该反应的平衡常数表达式:K=_________________,关于该反应的下列说法中,正确的是________。
A.△H>0,△S>0 B.△H>0,△S<0
C.△H<0,△S<0 D.△H<0,△S>0
(2)下图中表示NO2的变化的曲线是____________________,用O2表示从0-2s内该反应的平均速率v=_______________。
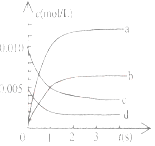
(3)能说明该反应已达到平衡状态的是__________。
A.v(NO2)=2v(O2) B.容器内压强保持不变
C.v (NO)=2v(O2) D.容器内密度保持不变
(4)下列措施中能使n(NO2)/n(NO)增大的有____。(填字母)
A.升高温度 B.加入催化剂
C.不断充入O2 D.充入He(g),使体系总压强增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钠(Na2FeO4)是一种新型高效多功能净水剂,电解浓NaOH溶液制备高铁酸钠的装置如图①所示。下列说法不正确的是( )

A. X为电源负极,铁电极发生的电极反应式是:Fe - 6e- + 8OH- = FeO42- + 4H2O
B. 离子交换膜为阳离子交换膜
C. 当生成1.66 gNa2FeO4时,收集到的气体在标准状况下的体积是672 mL
D. NaOH溶液的初始浓度与电解后生成的Na2FeO4浓度的变化关系如图②所示,c(Na2FeO4)降低的原因可能是发生了副反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com