
| 序号 | 1 | 2 | 3 | 4 | 5 | 6 |
| 导管及仪器 |  |  |  |  |  |  |
| 每个橡皮塞上都打了两个孔 | ||||||
| 64g×448×10-3L |
| 22.4L |
| 1.28 |
| 1.60 |


 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源: 题型:
 (其中R为烃基),相对分子质量为194.工业上以邻二甲苯(
(其中R为烃基),相对分子质量为194.工业上以邻二甲苯( )为原料先生产苯酐(
)为原料先生产苯酐( ),再使其与某醇在一定条件下反应可制得DMP.实验室由以下方法亦可得到DMP:
),再使其与某醇在一定条件下反应可制得DMP.实验室由以下方法亦可得到DMP: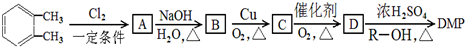
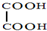 )在一定条件下可以按物质的量1:1发生反应可生成高分子化合物,反应的化学方程式为
)在一定条件下可以按物质的量1:1发生反应可生成高分子化合物,反应的化学方程式为查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(Na+)>c(A-)>c(H+)>c(OH-) |
| B、c(Na+)>c(OH-)>c(A-)>c(H+) |
| C、c(Na+)+c(H+)=c(A-)+c(OH-) |
| D、c(Na+)+c(OH-)=c(A-)+c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验目的 | 实验方法 |
| 除去 NaHC03溶液中少量的 Na2C03 | |
| 检验自来水中是否含有Cl- | |
| 证明 Na2C03溶液呈碱性 | |
| 除去FeCl3溶液中少量的FeCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 滴定次数 | ( | ( | |||
| ( | ( | ( | 平均值 | ||
| 1 | 10.00 | ||||
| 2 | 10.00 | ||||
| 3 | 10.00 | ||||
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
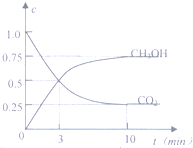 目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1L的客闭容器中,充入1molCO2和3molH2,在500℃下发生反应:CO2(g)+3H2O(g)?CH3OH(g)+H2O(g);
目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1L的客闭容器中,充入1molCO2和3molH2,在500℃下发生反应:CO2(g)+3H2O(g)?CH3OH(g)+H2O(g);查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com