
 磷化氢气体(PH3)是一种强烈的储粮害虫杀剂,其制取原理类似于实验室制氨气,空气中磷化氢气体达到2PPM以上是就会造成人畜中毒,请回答:
磷化氢气体(PH3)是一种强烈的储粮害虫杀剂,其制取原理类似于实验室制氨气,空气中磷化氢气体达到2PPM以上是就会造成人畜中毒,请回答:分析 (1)用氯化磷(PH4I)和NaOH反应制取PH3的反应可以依据反应氯化铵和氢氧化钠反应生成氨气类推;
(2)据降得还原氧化剂,升失氧化还原剂来分析氧化剂和还原剂;据24CuSO4+11PH3+12H2O=8Cu3P↓+3H3PO4+24H2SO4~24mole-来计算转移电子数目;
(3)据题干分析并且确定化学方程式;
(4)①组成氧硫化碳和磷化氢的原子为O、S、P、H,先判断电子层数,电子层数越多,原子半径越大;电子层数相同,再根据元素周期律,同周期元素的原子半径随着原子序数的增大而减小,主族元素周期数=电子层数,主族序数=最外层电子数;
②依据题干信息:硫离子和水反应生成硫代硫酸根离子和氢气,依据电荷守恒和原子守恒书写离子反应方程式;
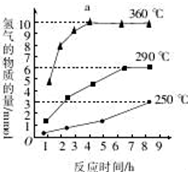
③根据图示反应时间与H2产量的关系,a点时M溶液中除S2O32-外,还有SO42-.
解答 解:(1)用氯化磷(PH4I)和NaOH反应为复分解反应生成PH3、碘化钠和水,制取PH3的化学方程式为:PH4 I+NaOH═PH3↑+NaI+H2O,
故答案为:PH4I+NaOH═PH3↑+NaI+H2O;
(2)24CuSO4+11PH3+12H2O=8Cu3P↓+3H3PO4+24H2SO4,CuSO4的化合价+2降低到+1价,化合价降低,故CuSO4为氧化剂,
24CuSO4+11PH3+12H2O=8Cu3P↓+3H3PO4+24H2SO4~24mole-
11 24
2.2 n
$\frac{11}{2.2}=\frac{24}{n}$,n=0.48
故答案为:CuSO4;0.48;
(3)氧硫化碳(COS)可替代磷化氢而被用作熏蒸剂.粉末状的KSCN与浓硫酸在一定条件下可得到COS和两种硫酸氢盐,生成物的物质的量之比为1:1:1,故方程式为:KSCN+2H2SO4(浓)+H2O=KHSO4+NH4HSO4+COS↑,
故答案为:KSCN+2H2SO4(浓)+H2O=KHSO4+NH4HSO4+COS↑
(4)①组成氧硫化碳和磷化氢的原子为O、S、P、H,氢元素有1个电子层,氧元素有2个电子层,磷、硫有3个电子层,所以磷、硫的原子半径大于氢、氧的原子半径,磷、硫是同周期元素,硫的原子序数大于磷的原子序数,由元素周期律知,磷的原子半径大于硫的原子半径,磷最外层为5个电子,处于第三周期第VA族,
故答案为:第三周期第VA族;
②依据题干信息:硫离子和水反应生成硫代硫酸根离子和氢气,根据硫原子守恒,产物需有因离子,根据原子守恒,产物还有氢氧根离子,反应为:2S2-+5H${\;}_{{\;}_{2}}$O$\frac{\underline{\;\;△\;\;}}{\;}$S2O32-+4H2↑+2OH-,故答案为:2S2-+5H${\;}_{{\;}_{2}}$O$\frac{\underline{\;\;△\;\;}}{\;}$S2O32-+4H2↑+2OH-;
③反应Ⅲ中,a点360℃时,随着时间推移,氢气的量不变,Na2S初始含量为3mmol,若只发生:2S2-+5H${\;}_{{\;}_{2}}$O$\frac{\underline{\;\;△\;\;}}{\;}$S2O32-+4H2↑+2OH-,生成氢气:3mmol×$\frac{4}{2}$=6mmol,图中为9mmol,说明M溶液中除S2O32-外,还有SO42-,反应为:S2-+4H2O$\frac{\underline{\;\;△\;\;}}{\;}$SO42-+4H2↑,
故答案为:SO42-.
点评 本题考查了物质性质、原子半径大小的比较、电子式和离子反应方程式的书写等,注意电子层结构相同的离子半径大小的比较方法.注意图象变化的同种分析,题目难度中等


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:选择题
| A. | CH3CH=CH2和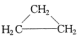 | B. | 乙炔和苯 | C. |  和 和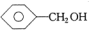 | D. | 乙酸和甲酸甲酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
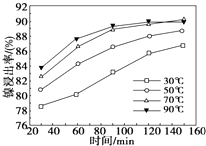 镍及其化合物具有优良的物理和化学特性,是许多领域尤其是高技术产业的重要原料.回答下列问题:
镍及其化合物具有优良的物理和化学特性,是许多领域尤其是高技术产业的重要原料.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 合金的性质与其成分金属的性质不完全相同 | |
| B. | 工业上金属Mg、Al都是用电解熔融的氯化物制得的 | |
| C. | 黑色的氧化铜灼烧会变成砖红色 | |
| D. | 将表面有铜绿[Cu2(OH)2CO3]的铜器放入盐酸中浸泡,除去铜绿 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 200mL | B. | 20mL | C. | 360mL | D. | 36mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 假设 | 实验操作 | 现象及结论 |
| 假设1:碳粉可用作还原剂,脱除硝酸盐 | 向烧杯中加入① 碳粉,一段时间后,测定烧杯中NO3-的浓度 | NO3-浓度无明显变化,说明假设Ⅰ不成立 |
| 假设2:碳粉、铁粉形成无数个微小的原电池,促进了硝酸盐的脱除 | 按图示组装实验装置,一段时间后,测定NO3-浓度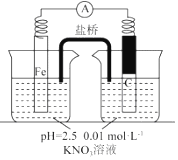 | ② Fe电极部分溶解,电流计指针偏转,说明假设2成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com