
| A. | 该元素原子中共有25个电子 | B. | 该元素原子核外有4个能层 | ||
| C. | 该元素原子最外层共有2个电子 | D. | 该元素原子M电子层共有8个电子 |
分析 A、该元素原子中共有25个电子;
B、某原子的电子排布式为1s22s22p63s23p63d54s2,所以该元素原子核外有4个能层;
C、3d54s2可知该元素原子最外层共有2个电子;
D、该元素原子M电子层共有2+6+5=13个电子.
解答 解:A、该元素原子中共有2+8+13+2=25个电子,故A正确;
B、某原子的电子排布式为1s22s22p63s23p63d54s2,所以该元素原子核外有4个能层,故B正确;
C、3d54s2可知该元素原子最外层共有2个电子,故C正确;
D、该元素原子M电子层共有2+6+5=13个电子,而不是8个电子,故D错误;
故选D.
点评 本题考查原子核外电子排布,根据构造原理推断出R的原子核外电子排布,本题难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.30 | B. | 0.35 | C. | 0.40 | D. | 0.50 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 89.6 mL | B. | 112 mL | C. | 168 mL | D. | 224 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
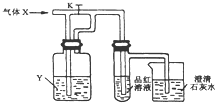
| A. | X是SO2,Y是饱和NaHCO3 溶液 | B. | X是H2S,Y是浓H2SO4 | ||
| C. | X是CO2,Y是Na2SO3 溶液 | D. | X是Cl2,Y是Na2CO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
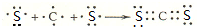 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Sn2+、Fe2+、Ce3+ | B. | Fe2+、Ce3+、Sn2+ | C. | Fe2+、Sn2+、Ce3+ | D. | Ce3+、Fe2+、Sn2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com