
| 2min | 4min | 6min | 8min | … | |
| CO | 0.07 | 0.06 | 0.06 | 0.05 | … |
| H2 | x | 0.12 | 0.12 | 0.2 | … |
| CH3OH | 0.03 | 0.04 | 0.04 | 0.05 | … |
分析 (1)已知:①CO2(g)+3H2(g)?CH3OH(l)+H2O(l)△H=-55.7kJ/mol
②2CH3OH(l)?CH3OCH3(g)+H2O (l)△H=-23.4kJ/mol
根据盖斯定律,①×2+②可得:2CO2(g)+6H2(g)=CH3OCH3(g)+3 H2O(l),反应热也进行相应的计算;
(2)平衡常数是指生成物平衡浓度化学计量数幂乘积与反应物平衡浓度化学计量数幂乘积的比,纯液体或固体不需要写出;
(3)①由表中数据可知,从2min到4min,CO的浓度变化量为(0.07-0.06)mol/L=0.01mol/L,根据方程式计算氢气的浓度变化量,2min时氢气浓度=4min时氢气浓度+氢气浓度变化量;
②4min与6min时,CO浓度相等,则4min、6min时反应处于平衡状态,平衡常数K=$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$,代入平衡浓度计算;
③对比6min和8min时各物质的浓度可知改变条件后反应反应向正方向进行,按照转化量之比等于计量系数之比△C(CO):△C(H2):△C(CH3OH)=0.01mol/L:0.02mol/L:0.01mol/L,所以8min后三种物质的浓度应为:(0.06-0.01)mol/L、(0.12-0.02)mol/L、(0.04+0.01)mol/L,而8min后氢气的浓度为0.2mol/L,所以多加了0.1mol/L×10=1mol的氢气;
④计算浓度商Qc,与平衡常数相比判断第8min时是否达到平衡状态;
⑤该合成反应的温度一般控制在240~270℃,选择此温度的原因是:此温度下的催化剂活性高;温度低,反应速率慢,单位时间内的产量低,而正反应为放热反应,温度过高,转化率降低.
解答 解:(1)已知:①CO2(g)+3H2(g)?CH3OH(l)+H2O(l)△H=-55.7kJ/mol
②2CH3OH(l)?CH3OCH3(g)+H2O (l)△H=-23.4kJ/mol
根据盖斯定律,①×2+②可得:2CO2(g)+6H2(g)=CH3OCH3(g)+3 H2O(l)△H=-134.8kJ/mol,
故答案为:2CO2(g)+6H2(g)=CH3OCH3(g)+3 H2O(l)△H=-134.8kJ/mol;
(2)CO2(g)+2NH3(g)?CO(NH2)2(l)+H2O (g)的平衡常数表达式K=$\frac{c({H}_{2}O)}{c(C{O}_{2})×{c}^{2}(N{H}_{3})}$,
故答案为:$\frac{c({H}_{2}O)}{c(C{O}_{2})×{c}^{2}(N{H}_{3})}$;
(3)①由表中数据可知,从2min到4min,CO的浓度变化量为(0.07-0.06)mol/L=0.01mol/L,根据方程式可知氢气的浓度变化量为0.01mol/L×2=0.02mol/L,2min时氢气浓度=0.12mol/L+0.02mol/L=0.14mol/L,
故答案为:0.14;
②4min与6min时,CO浓度相等,则4min、6min时反应处于平衡状态,故平衡常数K=$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$=$\frac{0.04}{0.06×0.1{2}^{2}}$mol-2.L2,
故答案为:$\frac{0.04}{0.06×0.1{2}^{2}}$mol-2.L2;
③对比6min和8min时各物质的浓度可知改变条件后反应反应向正方向进行,按照转化量之比等于计量系数之比△C(CO):△C(H2):△C(CH3OH)=0.01mol/L:0.02mol/L:0.01mol/L,所以8min后三种物质的浓度应为:(0.06-0.01)mol/L、(0.12-0.02)mol/L、(0.04+0.01)mol/L,而8min后氢气的浓度为0.2mol/L,所以多加了0.1mol/L×10L=1mol的氢气,
故答案为:加入1mol氢气;
④8min时浓度商Qc=$\frac{0.05}{0.05×0.{2}^{2}}$=25<K=$\frac{0.04}{0.06×0.1{2}^{2}}$=46.3,故8min时不是平衡状态,反应向正反应进行,
故答案为:不是;
⑤该合成反应的温度一般控制在240~270℃,选择此温度的原因是:此温度下的催化剂活性高;温度低,反应速率慢,单位时间内的产量低,而正反应为放热反应,温度过高,转化率降低,
故答案为:温度低,反应速率慢,单位时间内的产量低,而正反应为放热反应,温度过高,转化率降低.
点评 本题考查化学平衡计算及影响因素、平衡常数计算及应用、热化学方程式书写等,是对学生综合能力的考查,难度中等.


 特高级教师点拨系列答案
特高级教师点拨系列答案科目:高中化学 来源: 题型:选择题
| A. | $\frac{a}{2}$mol | B. | $\frac{b}{2}$mol | C. | ($\frac{a}{22.4}$-$\frac{b}{2}$)mol | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 检验某稀溶液中是否含有NO3-,可先将溶液浓缩,然后加入浓H2SO4和铜片,观察有无红棕色气体产生 | |
| B. | 鉴别NO2和溴蒸气可用AgNO3溶液,也可用湿润的淀粉-KI试纸 | |
| C. | 除去NO中的NO2气体,可通入氧气 | |
| D. | 检验溶液中是否含有NH4+,可加入足量NaOH溶液,加热,再将湿润的红色石蕊试纸伸入试管,观察试纸是否变蓝 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t1~t2 | t3~t4 | t4~t5 | t6~t7 |
| K1 | K2 | K3 | K4 |

| 物质 | CO2 | CH4 | CO | H2 |
| 浓度(mol•L-1) | 1 | 1 | 1 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 ),试写出该两步反应对应的化学方程
),试写出该两步反应对应的化学方程 ;
;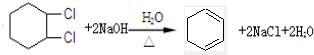 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②⑤ | B. | ⑤ | C. | ③④⑥ | D. | ③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O、Na2O2为相同元素组成的金属氧化物,都属于碱性氧化物 | |
| B. | SiO2、CO2均为酸性氧化物,均能与NaOH溶液反应生成盐和水 | |
| C. | FeO、Fe2O3均为碱性氧化物,与氢碘酸反应均只发生复分解反应 | |
| D. | 将Fe(OH)3胶体和泥水分别进行过滤,分散质均不能通过滤纸孔隙 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com