
| W | X | Y | ||
| R | Z |
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
 ,故答案为:
,故答案为: ;
;
| ||
| ||
| 0.1×0.1 |
| 0.4 |
| 0.1×0.2 |
| 0.5 |
| 0.1×0.2 |
| 0.5 |
| 0.1×0.1 |
| 0.4 |


科目:高中化学 来源: 题型:
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.16 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6,-2 | -1 | -2 |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学三轮复习排查 专题4物质结构 元素周期律练习卷(解析版) 题型:填空题
元素周期表是学习化学的重要工具,它隐含许多信息和规律。下表所列是五种短周期元素的原子半径及主要化合价:
元素代号ABCDE
原子半径/nm0.160.1430.1020.0890.074
主要化合价+2+3+6,-2+2-2
(1)在下表中标出上述五种元素在元素周期表中的对应位置(用元素符号)。
(2)在下表中标明通常寻找催化剂材料的区域(用斜线阴影)。

(3)A、B、E三种元素各自形成简单离子,其中半径最大的为________(填离子符号)。
(4)证明B元素的单质与A元素的单质在化学性质上有明显不同的离子方程式为:________________________。
(5)周期表中有些处于对角(左上→右下)位置的元素,它们的单质及其化合物的性质存在“对角线相似”的现象,请写出D的氧化物与强碱溶液反应的离子方程式:________________________。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年福建省福州市毕业班质量检查理综化学试卷(解析版) 题型:填空题
下表所列是元素周期表部分短周期的主族元素
|
|
W |
X |
Y |
|
|
R |
|
|
|
Z |
已知R为地壳中含量最多的金属元素。
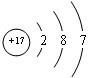
(1)写出Z的原子结构示意图________。
(2)W与氢原子形成6原子分子的结构简式_______。
(3)超细RX粉末被应用于大规模集成电路领域。其制作原理为R2Y3、X2、W在高温下反应生成两种化合物,这两种化合物均由两种元素组成,且原子个数比均为1∶1;其反应的化学方程式为_______。
(4)X最高价氧化物对应水化物与X气态氢化物反应的生成物溶于水中,所得溶液离子浓度从大到小的顺序是_______。
(5)火箭发动机的燃料胼(N2H4)与氧化剂N2O4反应生成N2和水蒸气。
已知①N2(g)+2O2(g)=N2O4(l) △H1=—195kJ•mol—1
②N2H4(l) +O2(g)=N2(g)+2H2O(g) △H2=—534.2kJ•mol—1
写出肼和N2O4反应的热化学方程式______________。
(6)温度为T时,向2.0L恒容密闭容器中充入1.00 mol PCl5,反应PCl5(g) PCl3(g)+Cl2(g),经过一段时间(t)后达到平衡。反应过程中测定的部分数据见下表:
PCl3(g)+Cl2(g),经过一段时间(t)后达到平衡。反应过程中测定的部分数据见下表:
|
t/s |
0 |
50 |
150 |
250 |
350 |
|
n(PCl3)/mol |
0 |
0.16 |
0.19 |
0.20 |
0.20 |
相同温度下,起始时向容器中充入1.00 mol PC15、0.20 mol PCl3和0.40 mol Cl2,反应达到平衡前v(正) _______v(逆)(填“>”或“=”或“<”);原因是_______。
查看答案和解析>>
科目:高中化学 来源:2015届广东省高一3月月考化学试卷(解析版) 题型:填空题
元素周期表是学习化学的重要工具,它隐含着许多信息和规律。下表所列是五种短周期的原子半径及主要化合价(已知铍的原子半径为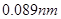 )
)

(1)B与D形成的化合物是 ;A和E形成的化合物是 。(填离子化合物或共价化合物)
(2)C的氢化物的电子式为 。
(3)B的最高价氧化物的水化物与C的最高价氧化物的水化物反应的离子方程式为: ;
(4)上述五种元素的最高价氧化物对应水化物的酸性最强的是 (填化学式);
(5)C、E形成的化合物为 、 (填化学式)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com