
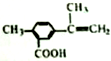
 ,有关该化合物的叙述正确的是( )
,有关该化合物的叙述正确的是( )| A. | 该有机物属于芳香烃 | |
| B. | 仅考虑取代基在苯环上的位置变化,M的同分异构体有9种 | |
| C. | 该有机物的碳原子一定处于同一平面 | |
| D. | 该有机物一定条件下只能发生加成反应和酯化反应 |
分析 有机物分子中含有羧基,具有酸性,可发生中和、酯化反应,含有碳碳双键,可发生加成、加聚和氧化反应,与苯环相连的原子一定与苯环在同一平面上,与双键碳原子相连的在同一平面,以此解答该题.
解答 解:A.该有机物含有氧原子,不属于烃,故A错误;
B.若甲基与羧基相邻,另外一个作为苯环上的取代基,共有4种;若甲基与羧基相间,有4种,甲基与羧基相对,有2种,除去题目本身的一种,共9种,故B正确;
C.与苯环相连的原子一定与苯环在同一平面上,与双键碳原子相连的可能在同一平面,但不一定在同一平面,双键碳上的甲基不一定与苯环在一个平面上,故C错误;
D.分子中含有羧基,可发生取代、酯化反应,含有碳碳双键,可发生加成、氧化反应,故D错误.
故选B.
点评 本题考查有机物的结构和性质,为高频常见题型,侧重于学生的分析能力的考查,注意把握有机物官能团的性质,为解答该类题目的关键,难度不大.


科目:高中化学 来源: 题型:解答题
| 实验序号 | ① | ② | ③ |
| 加入试剂(取等体积溶液) | 0.01mol/LKMnO4 0.1mol/LH2C2O4 | 0.01mol/LKMnO4 0.1mol/LH2C2O4 MnSO4固体 | 0.01mol/LKMnO4 0.1mol/LH2C2O4 Na2SO4固体 |
| 褪色时间/s | 116 | 6 | 117 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
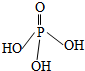 三聚磷酸可视为三个磷酸分子(磷酸结构式如图)之间脱去两个水分子的产物,三聚磷酸钠(俗称“五钠”)是常用的水处理剂.下列说法错误的是( )
三聚磷酸可视为三个磷酸分子(磷酸结构式如图)之间脱去两个水分子的产物,三聚磷酸钠(俗称“五钠”)是常用的水处理剂.下列说法错误的是( )| A. | 三聚磷酸中P的化合价为+5 | |
| B. | 三聚磷酸钠的化学式为Na3P3O10 | |
| C. | 按上述原理,四聚磷酸的化学式为H6P4O13 | |
| D. | 多聚磷酸的结构可表示为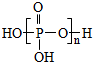 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
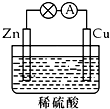
| A. | 铜极上发生氧化反应 | B. | 正极反应为:Cu-2e-=Cu2+ | ||
| C. | 电子由铜片通过导线流向锌片 | D. | 反应一段时间后,溶液的酸性减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1molNaOD溶于重水制成1L溶液,pD=13 | |
| B. | 将pD=4的DCl的重水溶液稀释100倍,所得溶液pD不等于6 | |
| C. | 向30mL0.5mol•L-1NaOD的重水溶液中加入20mL0.5mol•L-1DCl的重水溶液,所得溶液pD=11 | |
| D. | pD=10的NaOD的重水溶液中,由重水电离出的c(OD-)为1×10-10mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 砷元素的最高化合价为+3 | B. | 砷元素是第四周期第VA族的元素 | ||
| C. | 砷原子的M电子层有8个电子 | D. | 砷的氧化物的水溶液呈强碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. →
→ .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com