
在一定条件下,二氧化硫和氧气发生如下反应:2SO2+O2![]() 2SO3 ΔH<0。
2SO3 ΔH<0。
(1)写出该反应的化学平衡常数表达式:K=_____________________。
(2)降低温度,该反应K值________,二氧化硫的转化率________,化学反应速率________(以上均填“增大”“减小”或“不变”)。
(3)600 ℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3的物质的量变化如右图所示,反应处于平衡状态的时间是______________。

(4)据图判断,反应进行至20 min时,曲线发生变化的原因是______________(用文字表达),10 min~15 min的曲线变化的原因可能是______________(填写编号)。
A.加了催化剂 B.缩小容器体积
C.降低温度 D.增加SO3的物质的量
(1)c2(SO3)/ c2(SO2)·c(O2)
(2)增大 增大 减小(3)15 min~20 min和25 min~30 min
(4)增加了氧气的量 AB
(1)化学平衡常数是指一定温度下,达到平衡的可逆反应里生成物浓度的系数次方的乘积与反应物浓度系数次方的乘积之比,故K= c2(SO3)/c2(SO2)·c(O2)。
(2)降低温度,平衡向正反应方向移动,反应物浓度减小,生成物浓度增大,二氧化硫的转化率增大,但化学反应速率随温度降低而减小。
(3)由图示知:0~15 min时,反应物SO2和O2的量均逐渐减小,生成物SO3的量逐渐增多,15 min~20 min时,反应物和生成物的量均保持不变,说明反应处于平衡状态。25 min~30 min时,反应物和生成物的量均保持不变,说明反应处于平衡状态。
(4)反应进行到20 min时氧气物质的量突然增多为0.12 mol,而SO2和SO3仍与平衡时一致,说明此时增加了O2的量。10 min到15 min的曲线变化说明反应速率大幅增大,可能的原因是A加了催化剂,B缩小容器体积,增大压强;由于降低温度反应速率减小,不可能是C;SO3的量没有突然增多且平衡时SO2和SO3物质的量之和仍为0.20 mol,故D选项不可能。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
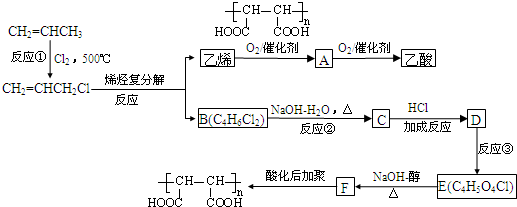
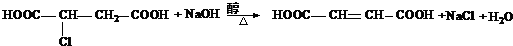
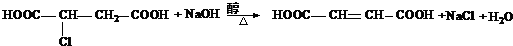
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:




查看答案和解析>>
科目:高中化学 来源: 题型:
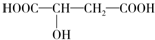 近年来流行喝苹果醋.苹果醋是一种由苹果发酵而成的具有解毒、降脂、减肥和止泻等作用的保健食品.苹果酸(α-羟基丁二酸)是这种饮料的主要酸性物质,其结构如图所示,下列相关说法正确的是( )
近年来流行喝苹果醋.苹果醋是一种由苹果发酵而成的具有解毒、降脂、减肥和止泻等作用的保健食品.苹果酸(α-羟基丁二酸)是这种饮料的主要酸性物质,其结构如图所示,下列相关说法正确的是( )| A、苹果酸在一定条件下能发生消去反应 | B、苹果酸在一定条件下能催化氧化生成醛 | C、苹果酸在一定条件下能发生加聚反应生成高分子化合物 | D、1 mol苹果酸与NaHCO3溶液反应最多消耗3 mol NaHCO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com