
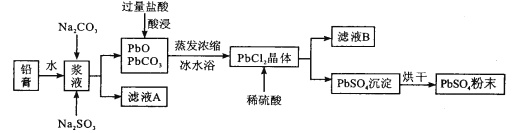
【题目】废旧铅蓄电池经粗加工可得到铅膏,其主要成分为PbO、PbO2、PbSO4等。以铅膏为原料回收PbSO4,流程如下:
已知:PbCl2(s)+2Cl-(aq)![]() PbCl42-(aq)ΔH>0
PbCl42-(aq)ΔH>0
(1)用Na2CO3作转化剂,将铅膏中的硫酸铅转化为碳酸铅,其离子方程式为_______。
(2)浆液中加入Na2SO3溶液的目的是________。
(3)从滤液A提取Na2SO4·10H2O晶体,主要步骤为______、______、过滤、洗涤、干燥;上述流程中可循环利用的物质是_________(写化学式)。
(4)采用冰水浴得PbCl2晶体的原因是________。
(5)理论上要得到a吨的PbSO4,则铅膏的质量范围为_________。
【答案】 PbSO4(s)+CO32-(aq)![]() PbCO3(s)+SO42-(aq) 将PbO2还原为PbO 蒸发浓缩 冷却结晶 HCl 由于PbCl2(s)+2Cl-(aq)
PbCO3(s)+SO42-(aq) 将PbO2还原为PbO 蒸发浓缩 冷却结晶 HCl 由于PbCl2(s)+2Cl-(aq)![]() PbCl42-(aq)ΔH>0,温度降低,平衡向生成PbCl2的方向移动,获得PbCl2晶体 (0.74a吨,a吨)或0.74a吨<m<a吨或223a/303吨<m<a吨
PbCl42-(aq)ΔH>0,温度降低,平衡向生成PbCl2的方向移动,获得PbCl2晶体 (0.74a吨,a吨)或0.74a吨<m<a吨或223a/303吨<m<a吨
【解析】(1)用Na2CO3作转化剂,将铅膏中的硫酸铅转化为碳酸铅,根据原子守恒可知还有硫酸钠生成,其离子方程式为PbSO4(s)+CO32-(aq)![]() PbCO3(s)+SO42-(aq);(2)亚硫酸钠具有还原性,可以把+4价Pb还原为+2价,因此浆液中加入Na2SO3溶液的目的是将PbO2还原为PbO;(3)滤液A能用来提取Na2SO4·10H2O,提取该晶体的主要步骤有蒸发浓缩、冷却结晶、过滤、洗涤、干燥等;硫酸与PbCl2反应生成PbSO4和HCl,所以上述流程中可循环利用的物质是HCl;(4)由于PbCl2(s)+2Cl-(aq)
PbCO3(s)+SO42-(aq);(2)亚硫酸钠具有还原性,可以把+4价Pb还原为+2价,因此浆液中加入Na2SO3溶液的目的是将PbO2还原为PbO;(3)滤液A能用来提取Na2SO4·10H2O,提取该晶体的主要步骤有蒸发浓缩、冷却结晶、过滤、洗涤、干燥等;硫酸与PbCl2反应生成PbSO4和HCl,所以上述流程中可循环利用的物质是HCl;(4)由于PbCl2(s)+2Cl-(aq)![]() PbCl42-(aq) ΔH>0,即反应为吸热反应,因此温度降低,平衡向生成PbCl2的方向移动,从而获得PbCl2晶体,所以采用冰水浴;(5)如果铅膏全部是硫酸铅,则需要铅膏a吨;PbO中Pb的含量最高,所以全部是PbO时需要铅膏的质量根据Pb原子守恒可知PbO~PbSO4,因此有
PbCl42-(aq) ΔH>0,即反应为吸热反应,因此温度降低,平衡向生成PbCl2的方向移动,从而获得PbCl2晶体,所以采用冰水浴;(5)如果铅膏全部是硫酸铅,则需要铅膏a吨;PbO中Pb的含量最高,所以全部是PbO时需要铅膏的质量根据Pb原子守恒可知PbO~PbSO4,因此有![]() ,即铅膏的质量m=
,即铅膏的质量m=![]() 吨,因此理论上要得到a吨的PbSO4,铅膏的质量范围为223a/303吨<m<a吨。
吨,因此理论上要得到a吨的PbSO4,铅膏的质量范围为223a/303吨<m<a吨。


科目:高中化学 来源: 题型:
【题目】(1)除去NaNO3固体中混有的少量KNO3,所进行的实验操作依次为________、蒸发、结晶、________。
(2)除去KCl溶液中的SO![]() ,依次加入的溶液为(填溶质的化学式): ________________________。
,依次加入的溶液为(填溶质的化学式): ________________________。
(3)下列物质的分离和提纯方法操作为
①油水混合物________;
②自来水制备蒸馏水________;
③碘水中的I2________;
④KNO3溶液得到KNO3________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A. MnO2与浓盐酸混合加热:MnO2+4H++4Cl-![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
B. NaAlO2溶液中通入过量CO2:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
C. FeSO4溶液中加入盐酸酸化的H2O2:Fe2++H2O2+2H+=Fe3++2H2O
D. Ca(HCO3)2溶液中加入过量氨水:Ca2++HCO3-+NH3·H2O=CaCO3↓+H2O+NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 反应2N2O(g)=2N2 (g)+O2(g)的△H<0,△S<0
B. 电解法精炼粗铜时,粗铜作阳极,纯铜作阴极
C. 反应KIO3+6HI=KI+3I2+3H2O,每消耗1molKIO3转移的电子数目为6×6.02×1023
D. 恒温恒容闭密容器中进行的反应C(s)+2NO(g)![]() N2(g)+CO2(g),当压强不再发生变化时,表明反应已达到平衡状态
N2(g)+CO2(g),当压强不再发生变化时,表明反应已达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国是世界上研究超导技术比较先进的国家,在高温超导材料中,铊(81Tl)是重要成分之,已知铊和铝是同主族元素,关于铊的性质推断错误的是
A.铊是银白色,质软的金属
B.铊不能形成稳定的气态氢化物
C.铊与浓硫酸反应生成T12(SO4)3
D.Tl(OH)3是两性氢氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下恒容容器中,对于可逆反应A(g)+2B(g) ![]() 3C(g)的下列描述中,能说明反应已达到平衡的是
3C(g)的下列描述中,能说明反应已达到平衡的是
A. 混合气体的密度不再变化
B. 单位时间内消耗amolA,同时生成3amolC
C. 容器内的压强不再变化
D. B的体积分数不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a、b、c、d为原子序数依次增大的短周期不同主族元素,其中只有一种为金属元素,四种元素的单质在通常情况下只有一种不是气体,b与d的最外层电子数之和为a与c最外层电子数之和的四倍。下列叙述不正确的是
A. 原子半径:c>d>a
B. d的氧化物对应的水化物酸性均比b的强
C. a、b、d三种元素形成的化合物可能既含离子键又含共价键
D. 单质的熔点:c>b>a
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com