
| 实验序号 | 反应温度/℃ | Na2S2O3溶液 | 稀H2SO4 | H2O | ||
| V/mL | c/(mol/L) | V/mL | c/(mol/L) | V/mL | ||
| ① | 20 | 10.0 | 0.10 | 10.0 | 0.50 | 0 |
| ② | 40 | V1 | 0.10 | V2 | 0.50 | V3 |
| ③ | 20 | V4 | 0.10 | 4.0 | 0.50 | V5 |
分析 (1)实验①、②的温度不同,故可探究温度对反应速率的影响,而要探究温度对反应速率的影响,则必须保持其他影响因素一致;
(2)实验①、③加入的硫酸的量不同,故可探究浓度对反应速率的影响,而要探究硫酸的浓度不同对反应速率的影响,则必须保持其他影响因素一致.
解答 解:(1)实验①、②的温度不同,故可探究温度对反应速率的影响;而要探究温度对反应速率的影响,则必须保持其他影响因素一致:即加入的Na2S2O3溶液的量相同,故V1=10.0mL,加入的硫酸的量相同,故V2=10.0mL,加入水的体积相等,故V3=0,
故答案为:温度;10.0;10.0;0;
(2)实验①、③加入的硫酸的量不同,故可探究浓度对反应速率的影响;而要探究硫酸的浓度不同对反应速率的影响,则必须保持其他影响因素一致,即加入的Na2S2O3溶液的量相同,故V4=10.0mL,溶液总体积也须相同,故加入的水的体积V5=6.0mL,
故答案为:浓度;10.0;6.0.
点评 本题考查探究影响反应速率的因素,为高频考点,把握浓度、温度对反应速率的影响为解答的关键,侧重分析与实验能力的考查,注意控制变量法的应用,题目难度不大


科目:高中化学 来源: 题型:选择题
| A. | 硫酸铝溶液中加入过量氨水 Al3++3OH-═Al(OH)3↓ | |
| B. | 碳酸钠溶液中加入澄清石灰水 Ca(OH)2+CO32-═CaCO3↓+2OH- | |
| C. | 向NaHCO3溶液中加入少量的澄清石灰水,出现白色沉淀2HCO3-+Ca2++2OH-═CaCO3↓+CO32-+2H2O | |
| D. | 稀硫酸中加入铁粉 2Fe+6H+═2Fe3++3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
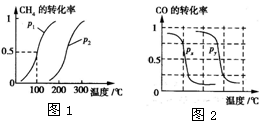 甲醇是一种很好的燃料,工业上用CH4和H2O(g)为原料,通过反应I和II来制备甲醇.请回答下列问题:
甲醇是一种很好的燃料,工业上用CH4和H2O(g)为原料,通过反应I和II来制备甲醇.请回答下列问题:| 实验编号 | T(℃) | n(CO)/n(H2) | p(MPa) |
| l | 150 | $\frac{1}{3}$ | 0.1 |
| 2 | n | $\frac{1}{3}$ | 5 |
| 3 | 350 | m | 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 给反应体系适当加热 | B. | 向反应体系中加水稀释 | ||
| C. | 加入少量氧化铜固体 | D. | 加入催化剂或加压 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中一定不含NO3- | |
| B. | 该溶液中一定含K+,且c(K+)≥0.1mol/L | |
| C. | 该溶液中可能含K+ | |
| D. | 该溶液中肯定含有NO3?、SO42-、NH4+、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃,1.01×105Pa,11.2L Cl2含有的分子数小于0.5NA | |
| B. | 物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl-个数为1NA | |
| C. | 1molFeCl3与沸水反应生成NA个Fe(OH)3胶粒 | |
| D. | 常温下,23 g NO2含有2NA个氧原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
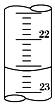 中和滴定的相关问题
中和滴定的相关问题| 滴定次数 | 待测体积(mL) | 标准烧碱溶液体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 20.00 | 0.40 | 20.40 |
| 第二次 | 20.00 | 2.00 | 24.10 |
| 第三次 | 20.00 | 4.00 | 24.00 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com