
分析 经2min后,A的浓度从开始时的1.0mol/L降到0.8mol/L.已知反应开始时B的浓度是0.8mol/L,则
A+2B?3C
开始 1.0 0.8 0
转化 0.2 0.4 0.6
2min 0.8 0.4 0.6
并结合v=$\frac{△c}{△t}$、转化率=$\frac{转化的量}{开始的量}$×100%计算.
解答 解:经2min后,A的浓度从开始时的1.0mol/L降到0.8mol/L.已知反应开始时B的浓度是0.8mol/L,则
A+2B?3C
开始 1.0 0.8 0
转化 0.2 0.4 0.6
2min 0.8 0.4 0.6
( 1 )由上述分析可知,2min末B,C的浓度为0.6mol/L,
答:2min末B,C的浓度为0.6mol/L;
( 2 )2min内C的平均化学反应速率为$\frac{0.6mol/L}{2min}$=0.3mol/(L.min),
答:2min内C的平均化学反应速率为0.3mol/(L.min);
( 3 )2min末时物质B的转化率为$\frac{0.4mol/L}{0.8mol/L}$×100%=50%,
答:2min末时物质B的转化率为50%.
点评 本题考查化学平衡的计算,为高频考点,把握化学平衡三段法、速率及转化率的计算为解答的关键,侧重分析与计算能力的考查,注意转化的浓度的关系,题目难度不大.


科目:高中化学 来源: 题型:解答题
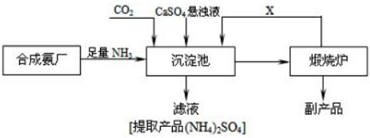
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
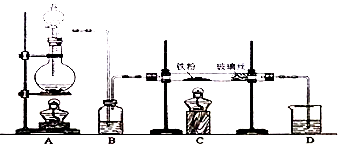
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
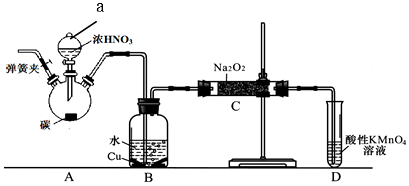
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 是否为大量分子和离子的集合体 | B. | 能否通过滤纸或半透膜 | ||
| C. | 分散质粒子的大小 | D. | 是否均一、稳定、透明 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ②④⑥ | C. | ①③⑥ | D. | ③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
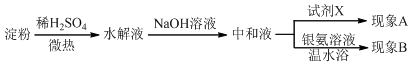
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.20 | B. | 0.25 | C. | 0.30 | D. | 0.35 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com