
【题目】碳酸锂广泛应用于陶瓷和医药等领域,在水中的溶解度比较小。以锂辉石(主要成分为Li2O,含有少量SiO2、Al2O3、Fe2O3)为原料制备Li2CO3的流程如图:
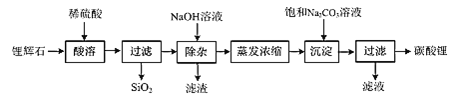
⑴写出“酸溶”时Li2O发生反应的离子方程式:______。
⑵“除杂”时所用NaOH溶液不能过量,原因是______。
⑶“除杂”时检验铁元素已完全除去的方法是______。
⑷写出“沉淀”时反应的化学方程式:______。
⑸检验最终所得碳酸锂样品中是否含有Na2CO3的方法是:______。
【答案】Li2O+2H+=2Li++H2O 若NaOH过量,Al(OH)3溶解生成NaAlO2 静置,取上层清液滴加KSCN溶液,溶液不显红色则铁元素已完全除去 Na2CO3+Li2SO4=Li2CO3↓+Na2SO4 用洁净的铁丝(或铂丝)蘸取碳酸锂样品于酒精灯外焰上灼烧,若火焰呈黄色则含Na2CO3,反之则不含
【解析】
以锂辉石(主要成分为Li2O,含有少量SiO2、Al2O3、Fe2O3)为原材料制备Li2CO3,加硫酸,浸取,酸浸后得到的酸性溶液中含有Li+、SO42-,另含有Al3+、Fe3+等杂质,加入氢氧化钠溶液使Al3+、Fe3+转化为氢氧化物沉淀,过滤,将滤液蒸发浓缩,再加饱和碳酸钠溶液得到碳酸锂沉淀,过滤得到碳酸锂,据此分析解答。
(1)“酸溶”时Li2O被硫酸溶解,反应的离子方程式为Li2O+2H+=2Li++H2O,故答案为:Li2O+2H+=2Li++H2O;
(2)因氢氧化铝为两性氢氧化物,可与氢氧化钠反应,则“除杂”时所用NaOH溶液不能过量,否则Al(OH)3溶解生成NaAlO2,故答案为:若NaOH过量,Al(OH)3溶解生成NaAlO2;
(3)检验铁离子,可静置,取上层清液滴加KSCN溶液,溶液不显红色,则证明铁元素已完全除去,故答案为:静置,取上层清液滴加KSCN溶液,溶液不显红色,则铁元素已完全除去;
(4)“沉淀”时饱和碳酸钠溶液与Li+反应生成碳酸锂沉淀,反应的化学方程式为Na2CO3+Li2SO4=Li2CO3↓+Na2SO4,故答案为:Na2CO3+Li2SO4=Li2CO3↓+Na2SO4;
(5)可用焰色反应检验钠盐,方法是用洁净的铁丝(或铂丝)蘸取碳酸锂样品在酒精灯外焰上灼烧,若火焰呈黄色则含Na2CO3,反之则不含,故答案为:用洁净的铁丝(或铂丝)蘸取碳酸锂样品于酒精灯外焰上灼烧,若火焰呈黄色则含Na2CO3,反之则不含。


 教学练新同步练习系列答案
教学练新同步练习系列答案科目:高中化学 来源: 题型:
【题目】下列各反应中属于加成反应的是( )
A. H2+Cl2![]() 2HCl
2HCl
B. CH2===CH2+3O2![]() 2CO2+2H2O
2CO2+2H2O
C. CH2===CH2+H2O![]() CH3CH2OH
CH3CH2OH
D. CH3—CH3+2Cl2![]() CH2Cl—CH2Cl+2HCl
CH2Cl—CH2Cl+2HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】开发、使用清洁能源发展“低碳经济”,正成为科学家研究的主要课题。氢气、甲醇是优质的清洁燃料,可制作燃料电池。生产甲醇的原料CO和H2来源于:CH4(g)+H2O(g) CO(g)+ 3H2(g)。
(1)一定条件下CH4的平衡转化率与温度、压强的关系如图a。则,Pl __P2(填“<”、“>”“=”);A、B、C三点处对应平衡常数(KA、KB、KC)由大到小的顺序为___。
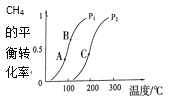
(2)100℃时,将1 mol CH4和2 mol H2O通入容积固定为10 L的反应室,如果5min达到平衡时CH4的转化率为0.5,则H2的反应速率v(H2)=____。100℃时该反应的平衡常数K =____。反应达到平衡的标志是:____。
A.容器内气体密度恒定 B.单位时间内消耗0.1 mol CH4同时生成0.3 molH2
C.容器的压强恒定 D.3v正(CH4)= v逆(H2)
(3)为了加快化学反应速率且使体系中气体的物质的量减少,其他条件不变时,可采取的措施有____(填编号)。
A.升高温度 B.缩小容器体积
C.再充入CH4气体 D.使用合适的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是应用广泛的金属。以铝土矿(主要成分为Al2O3,含SiO2和Fe2O3等杂质)为原料制备铝的一种工艺流程如下:
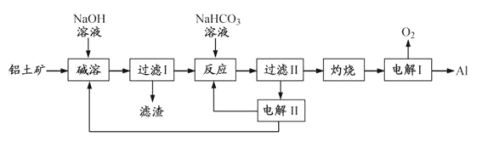
注:SiO2在“碱溶”时转化为铝硅酸钠沉淀。
(1)“碱溶”时生成偏铝酸钠的离子方程式为___。
(2)向“过滤Ⅰ”所得滤液中加入NaHCO3溶液,溶液的pH___(填“增大”、“不变”或“减小”)。
(3)“电解Ⅰ”是电解熔融Al2O3,电解过程中作阳极的石墨易消耗,原因是___。冰晶石的作用是___。
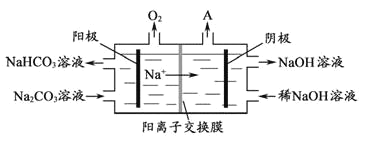
(4)“电解Ⅱ”是电解Na2CO3溶液,原理如图所示。阴极产生的物质A的化学式为___;电解时,若阴极生成标况下44.8L的A,则阳极产生NaHCO3的质量为___g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘单质与氢气在一定条件下反应的热化学方程式如下:
①I2(g)+H2(g)![]() 2HI(g) △H=-9.48kJ·min-1
2HI(g) △H=-9.48kJ·min-1
②I2(s)+H2(g)![]() 2HI(g) △H=+26.48kJ·min-1
2HI(g) △H=+26.48kJ·min-1
下列说法正确的是
A.该条件下,l mol H2(g)和l mol I2(g)充分反应,放出热量9.48kJ
B.该条件下,碘升华的热化学方程式为I2(s)=I2(g) △H=+35.96kJ·min-1
C.相同条件下,Cl2(g)+H2(g)=2HCl(g)的△H >-9.48 kJ·min-1
D.反应①是放热反应,所以反应①的活化能大于反应②的活化能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究某物质X(仅含两种元素)的组成及和性质,设计并完成如下实验。(气体体积己转化为标准状况下的体积)
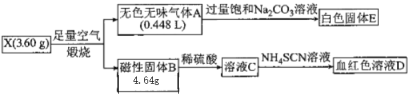
请回答下列问题:
(1)X的化学式__________,A的电子式_____________。
(2)无色气体A通入饱和碳酸钠溶液中的离子方程式__________。
(3)溶液C中滴加NH4SCN溶液可以检验某种阳离子的存在,请设计实验检验溶液C中另一种金属阳离子的实验方案_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组按下列路线合成非甾体抗炎、抗过敏药物乙氧苯柳胺,工业上可通过分馏煤焦油获得A。
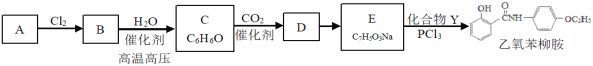
已知:R-Cl+R'-OH![]() R-O-R'+HCl;
R-O-R'+HCl;
![]()
![]()
![]()
请回答:NH2
(1)反应B→C的类型是__________,化合物D中含氧官能团的名称______。
(2)下列说法正确的是_________。
A 化合物C加入过量溴的四氯化碳溶液中,能产生白色沉淀
B 化合物D能发生加成、取代、氧化反应、缩聚反应
C 实现D→E的转化应加入过量Na2CO3溶液
D 乙氧苯柳胺的分子式是C15H15NO3
(3)化合物E的结构简式是__________。
(4)化合物D能与许多物质反应,如:化合物D与足量NaOH溶液反应生成有机物X,请写出少量CO2通入X溶液中发生反应的化学方程式__________。
(5)写出化合物Y(C8H11NO)同时符合下列条件的所有同分异构体的结构简式_______。
1H-NMR谱和1R谱检测表明:
①分子中有4种不同化学环境的氢原子。
②分于中含有苯环,没有羟基。
(6)结合题目信息,设计以B和CH3CH2OH为原料制备化合物Y的合成路线(用流程图表示,无机试剂任选)__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯化铁溶液可腐蚀印刷电路板.上的铜膜,某教师为了从腐蚀废液(含有大量FeCl3、FeCl2、CuCl2)中回收铜,并将铁的化合物全部转化为FeCl3溶液作为腐蚀液原料循环使用。准备采用下列步骤:
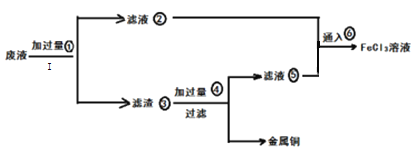
(1)步骤I的操作名称:_________________ :所需玻璃仪器:_______________________
(2)写出FeCl3溶液与铜箔发生反应的离子方程式:__________________________________
(3)检验废腐蚀液中是否含有Fe3+所需试剂:______________________(填名称)
(4)向②中加入NaOH溶液并长时间暴露在空气中,此过程的现象:_______________________此转化的化学方程式为:___________________________________________________________
(5)写出③中所含物质:__________________(填化学式)⑥发生反应的离子方程式:________
(6)若向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉。反应结束后,下列结果不可能出现的是_____(填写编号)
A.有铜无铁 B.有铁无铜 C.铁、铜都有 D.铁、铜都无
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com