
| A. | 用硫和硫铁矿均可做为原料 | |
| B. | SO2转化为SO3,需在催化剂和加热条件下进行 | |
| C. | SO3可用水直接吸收 | |
| D. | 热交换器可对生成气体冷却,对原料气体加热 |
分析 根据工业上接触法制硫酸的原料和步骤来解答,我国主要原料是硫铁矿,硫也可以,步骤分为三步:二氧化硫的制备与干燥、二氧化硫转化为三氧化硫、三氧化硫的吸收,三步分别在沸腾炉、接触室、吸收塔中进行,在接触室内SO2氧化成SO3时需使用催化剂,接触室中热交换器的主要作用是预热未反应的气体和冷却反应后的气体,可节省能源,在吸收塔中三氧化硫与水反应生成硫酸,但水直接吸收三氧化硫会形成酸雾,使三氧化硫的吸收率降低,生成实践中用98.3%的浓H2SO4吸收三氧化硫,可以防止形成酸雾,使SO3吸收完全.
解答 解:A.我国硫铁矿资源储量居世界前列,所以工业上接触法制硫酸,主要原料是硫铁矿,但硫磺也是可以的,反应原理:FeS2 (或S)→SO2→SO3→H2SO4,故A正确;
B.在接触室内SO2氧化成SO3时需使用催化剂和加热条件,加快化学反应速率,提高生产效率,故B正确;
C.在吸收塔中三氧化硫与水反应生成硫酸,但水直接吸收三氧化硫会形成酸雾,使三氧化硫的吸收率降低,生成实践中用98.3%的浓H2SO4吸收三氧化硫,可以防止形成酸雾,故C错误;
D.接触室中SO2氧化成SO3的反应是放热反应,所以在管道内流动的是热气体,在管道外流动的是冷气体,二者在管壁进行热交换,使得管内的SO3气体得到冷却,管外流动的SO2和O2受到预热,就不需要外界给反应物始终加热,而是利用反应自身放出的热量使反应发生,可节省能源,故D正确;
故选C.
点评 本题考查了工业上接触法制硫酸的原料和步骤,明确发生的化学反应及设备、原料、在生产实践中采用98.3%的浓硫酸吸收的原因是解答本题的关键.


科目:高中化学 来源: 题型:选择题
| A. | 灼热的碳与CO2的反应 | B. | Ba(OH)2•8H2O与NH4Cl的反应 | ||
| C. | 铝片与稀盐酸的反应 | D. | 甲烷在氧气中的燃烧反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
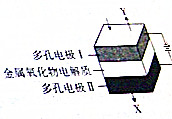
| A. | X的成分是H2和CO | |
| B. | 阳极的电极反应式为2O2--4e-=O2↑ | |
| C. | 电解质中的O2-移向电极I | |
| D. | 当阴极上有2mol气体生成时,通过电解质的电子数目为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为提高反应速率和原料利用率,硫铁矿要在“沸腾”状态下燃烧 | |
| B. | 为防止催化剂中毒,气体在进接触室前要先净化 | |
| C. | 接触室中热交换器的主要作用是预热未反应的气体和冷却反应后的气体 | |
| D. | 吸收塔中SO3从下而上,水从上而下喷,剩余气体从上部出来循环利用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
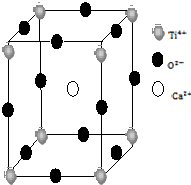 金属Ti性能优越,被誉为继Fe、Al后广泛应用的“第三金属”.
金属Ti性能优越,被誉为继Fe、Al后广泛应用的“第三金属”.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LN2中含有π健数为3NA | |
| B. | 12g金刚石中含有C-C键数为4NA | |
| C. | 25℃时,pH=12的CH3COONa溶液中水电离出的OH-的数目为0.01NA | |
| D. | 当反应3(NH4)2SO4$\frac{\underline{\;\;△\;\;}}{\;}$4NH3↑+3SO2↑+N2↑+6H2O生成89.6L标准状况的气体时,转移的电子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
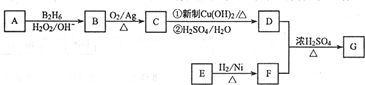
 .
. .
.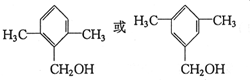 (写出一种即可).
(写出一种即可).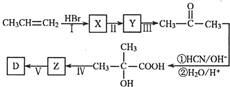
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12C60与14C60互为同位素 | |
| B. | 14C转变为12C的过程属于化学变化 | |
| C. | 12C与14C的原子中含有的中子数之比为3:4 | |
| D. | 金刚石与C60都属于原子晶体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com