
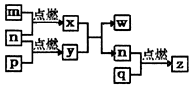
 短周期主族元素,a、b、c、d的原子序数依次增大.四种元素形成的单质依次为m、n、p、q时;x、y、z是这些元素组成的二元化合物,其中z为形成酸雨的主要物质之一;25℃0.01mol•L-1w溶液中,$\frac{c({H}^{+})}{c(O{H}^{-})}$=1.0×10-10.上述物质的转化关系如图所示.下列说法正确的是( )
短周期主族元素,a、b、c、d的原子序数依次增大.四种元素形成的单质依次为m、n、p、q时;x、y、z是这些元素组成的二元化合物,其中z为形成酸雨的主要物质之一;25℃0.01mol•L-1w溶液中,$\frac{c({H}^{+})}{c(O{H}^{-})}$=1.0×10-10.上述物质的转化关系如图所示.下列说法正确的是( )| A. | 原子半径的大小:a<b<c<d | B. | 氢化物的沸点:b>d | ||
| C. | x的电子式为: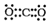 | D. | z、w含有的化学键类型完全相同 |
分析 短周期主族元素,a、b、c、d的原子序数依次增大.四种元素形成的单质依次为m、n、p、q时;x、y、z是这些元素组成的二元化合物,其中z为形成酸雨的主要物质之一,z为SO2,q为S,d为S元素;25℃0.01mol•L-1w溶液中,$\frac{c({H}^{+})}{c(O{H}^{-})}$=1.0×10-10,w为强碱溶液,则w为NaOH,结合原子序数及图中转化可知,a为H,b为O,c为Na,x为H2O,y为Na2O2,以此来解答.
解答 解:由上述分析可知,a为H,b为O,c为Na,d为S,
A.电子层越多,原子半径越大,同周期从左向右原子半径减小,则原子半径的大小:a<b<d<c,故A错误;
B.水分子间含氢键,氢化物的沸点:b>d,故B正确;
C.x为H2O,其电子式为 ,故C错误;
,故C错误;
D.z为SO2,只含共价键,而w为NaOH,含离子键、共价键,故D错误;
故选B.
点评 本题考查无机物的推断,为高频考点,把握元素化合物知识、物质的转化推断物质及元素为解答的关键,侧重分析与推断能力的考查,注意酸雨、w为NaOH为推断的突破口,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②④ | C. | ①② | D. | ③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5,4,3 | B. | 4,4,3 | C. | 4,3,3 | D. | 3,3,3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 短周期元素W、X、Y、Z、Q的原子序数依次增大,已知A、B、C、D是它们两种或三种元素间形成的化合物,且A、B、C均含有Z元素.A的焰色反应呈黄色,水溶液呈弱碱性;B是两性氢氧化物;D是由W与Q形成的化合物,0.1mol•L-1D溶液的pH为1.在一定条件下它们之间的相互转化关系如图所示.下列说法正确的是( )
短周期元素W、X、Y、Z、Q的原子序数依次增大,已知A、B、C、D是它们两种或三种元素间形成的化合物,且A、B、C均含有Z元素.A的焰色反应呈黄色,水溶液呈弱碱性;B是两性氢氧化物;D是由W与Q形成的化合物,0.1mol•L-1D溶液的pH为1.在一定条件下它们之间的相互转化关系如图所示.下列说法正确的是( )| A. | X、Y、Z元素的离子半径大小是X>Y>Z | |
| B. | x元素的氢化物沸点比同主族元素的氢化物低 | |
| C. | Y与Q和W与Q元素形成的化合物化学键类型相同 | |
| D. | q的最高价氧化物对应的水化物和氢化物的酸性在同主族元素中是最强的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第ⅠA族元素都是典型的金属元素 | |
| B. | 过渡元素都是金属元素 | |
| C. | 任何元素的原子都是由核外电子和核内质子、中子所组成 | |
| D. | 均属“镧系元素”的镧(57La)与铈(58Ce)互为同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 纳米级Cu2O由于具有优良的催化性能而备受关注,下表为制取纳米级Cu2O的三种方法:
纳米级Cu2O由于具有优良的催化性能而备受关注,下表为制取纳米级Cu2O的三种方法:
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6.2g白磷中所含P-P键的数目为0.15NA | |
| B. | 含H2O2 3.4克的溶液完全分解,其电子转移数目为NA | |
| C. | 117g氯化钠固体含有2NA个氯化钠分子 | |
| D. | 6克金刚石含NA个C-C键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 起始温度t1/℃ | 终止温度(t2)/℃ | 温差(t2-t1)/℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 28.3 | 3.3 |
| 2 | 25.1 | 25.1 | 25.1 | 28.4 | 3.3 |
| 3 | 25.1 | 25.1 | 25.1 | 28.5 | 3.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com