
| A. | 若2H2(g)+O2(g)═2H2O(g)△H=-483.6 kJ•mol-1,则H2燃烧热为241.8 kJ•mol-1 | |
| B. | 在稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol,若将含0.6 mol H2SO4的稀硫酸与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ | |
| C. | 已知C(石墨,s)═C(金刚石,s)△H>0,则金刚石比石墨稳定 | |
| D. | 由BaSO4(s)+4C(s)═4CO(g)+BaS(s)△H1=+571.2kJ•mol-1①BaSO4(s)+2C(s)═2CO2(g)+BaS(s)△H2=+226.2kJ•mol-1②可得反应C(s)+CO2(g)═2CO(g) 的△H=+172.5kJ•mol-1 |
分析 A.燃烧热是1mol的可燃物完全燃烧产生稳定的氧化物时所放出的热量,水的稳定状态是液体;
B.中和热是指强酸与强碱的稀溶液完全中和生成1mol水时放出的热量,碱不足量,放出的热量按照碱来计算;
C.石墨完全转化为金刚石时,要吸收能量,说明金刚石能量高于石墨,能量越低越稳定;
D.利用盖斯定律将$\frac{①-②}{2}$可得:C(s)+CO2(g)═CO(g);计算反应热.
解答 解:A.若2H2(g)+O2(g)=2H2O(g)△H=-483.6 kJ•mol-1,由于燃烧热是1mol的可燃物完全燃烧产生稳定的氧化物时所放出的热量,水的稳定状态是液体,所以H2燃烧热大于241.8 kJ/mol,故A错误;
B.在稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol,若将含0.6 mol H2SO4的稀硫酸与含1 mol NaOH的溶液混合,由于碱不足量,放出的热量按照碱来计算,放出的热量仍然等于57.3 kJ,故B错误;
C.C(石墨,s)═C(金刚石,s)△H>0,石墨完全转化为金刚石时,要吸收能量,说明金刚石能量高于石墨,能量越低越稳定,所以石墨比金刚石稳定,故C错误;
D.已知:①BaSO4(s)+4C(s)═4CO(s)+BaS(s)△H=+571.2KJ/mol,②BaSO4(s)+2C(s)═2CO2(s)+BaS(s)△H=+226.2KJ/mol,利用盖斯定律将$\frac{①-②}{2}$可得:C(s)+CO2(g)═CO(g);△H=$\frac{571.2kJ/mol-226.2kJ/mol}{2}$=+172.5kJ/mol,故D正确;
故选D.
点评 本题考查了热化学方程式及盖斯定律的应用,明确燃烧热、中和热、盖斯定律的含义和构建目标方程式的方法是解题的关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 淡化海水,可向海水中加入净水剂明矾或Na2FeO4 | |
| B. | 金属钠着火,可用水扑灭 | |
| C. | 在电闪雷鸣的雨天,N2与O2会发生反应并最终转化为硝酸盐被植物吸收 | |
| D. | 光导纤维属于有机合成新材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
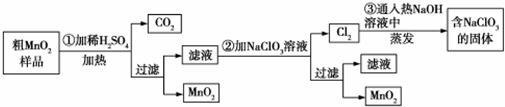
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
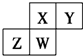
| A. | 原子半径:W>Z>Y>X | |
| B. | W的最高正价与最低负价的绝对值可能相等 | |
| C. | 气态氢化物的稳定性:Z>W>X>Y | |
| D. | Z的最高价氧化物的水化物可能为强碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com