
 ,32gO3中氧原子的物质的量,再根据N=nNA计算氧原子数目,据此判断.
,32gO3中氧原子的物质的量,再根据N=nNA计算氧原子数目,据此判断.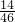 ,氧元素的质量分数为
,氧元素的质量分数为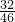 ,计算氮元素与氧元素的质量,根据n=
,计算氮元素与氧元素的质量,根据n= 计算氮原子与氧原子物质的量,结合根据N=nNA计算原子数目.
计算氮原子与氧原子物质的量,结合根据N=nNA计算原子数目.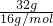 =2mol,所以32gO3中含有氧原子数目为
=2mol,所以32gO3中含有氧原子数目为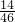 ,氧元素的质量分数为
,氧元素的质量分数为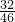 ,
,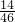 =28g,氮原子的物质的量为2mol,氧元素的质量为92g×
=28g,氮原子的物质的量为2mol,氧元素的质量为92g×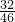 =64g,所以氧原子的物质的量为4mol,故46gNO2和46gN2O4含有的原子总数为(2mol+4mol)×NAmol-1=6NA,故C错误;
=64g,所以氧原子的物质的量为4mol,故46gNO2和46gN2O4含有的原子总数为(2mol+4mol)×NAmol-1=6NA,故C错误;

 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com