
下列溶液中,溶质的物质的量浓度为1mol/L的是()
A. 将40 g NaOH溶于1 L 水所得的溶液
B. K+为0.5 mol的K2SO4溶液
C. 将0.5 mol/L的NaNO3溶液100 mL 加热蒸发掉50 g水所得的溶液
D. 含0.2molNO3﹣的Cu(NO3)2溶液100mL
考点: 物质的量浓度的相关计算.
分析: A.40gNaOH物质的量为1mol,溶于水配成1L溶液,溶质的物质的量浓度为1mol/L;
B.溶液体积未知,不能确定溶液浓度;
C.溶液蒸发掉50g水,剩余溶液的体积不是50mL;
D.硝酸铜物质的量为硝酸根的一半,再根据c= 计算判断.
计算判断.
解答: 解:A.40gNaOH物质的量为1mol,溶于水配成1L溶液,溶质的物质的量浓度为1mol/L,体积1L应是溶液体积,不是溶剂的体积,故A错误;
B.溶液体积未知,不能确定K2SO4溶液浓度,故B错误;
C.溶液蒸发掉50g水,剩余溶液的体积不是50mL,故C错误;
D.硝酸铜物质的量为 =0.1mol,硝酸铜的物质的量浓度为
=0.1mol,硝酸铜的物质的量浓度为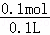 =1mol/L,故D正确,
=1mol/L,故D正确,
故选D.
点评: 本题考查物质的量浓度概念与有关计算,比较基础,注意对基础知识的理解掌握.


科目:高中化学 来源: 题型:
能正确表示下列化学反应的离子方程式的是()
A. 氢氧化钡溶液与盐酸的反应 2OH﹣+2H+=2H2O
B. 澄清的石灰水与稀盐酸反应 Ca(OH)2+2H+=Ca2++2H2O
C. 铜片插入硝酸银溶液中 Cu+Ag+=Cu2++Ag
D. 碳酸钙溶于稀盐酸中 CaCO3+2H+=Ca2++H2O+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应中不属于氧化还原反应是()
A. H2+CuO 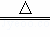 Cu+H2O
Cu+H2O
B. Ca2++CO32﹣═CaCO3↓
C. 3Cu+8H++2NO3﹣═3Cu2++2NO↑+4H2O
D. 2H2O2 2H2O+O2↑
2H2O+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
将标准状况下的HCl气体6.72L溶于水配成500ml盐酸溶液,
(1)该盐酸溶液的物质的量浓度
(2)取该盐酸400ml和足量的碳酸钙完全反应后生成的CO2气体在标况下的体积为多少?(写计算过程)
(3)将生成的CO2气体通入到一定量的Na2O2固体中,充分反应后固体质量比原增加1.4g,则参加反应的CO2气体的物质的量为 mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,PbO2与Cr3+反应,产物是Cr2O72﹣和Pb2+,则生成1molCr2O72﹣ 所需PbO2的物质的量为()
A. 3.0mol B. 1.5mol C. 1.0mol D. 0.75mol
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学按下列步骤配制500mL 0.20mol•L﹣1KCl溶液,请回答有关问题.
实验步骤 有关问题
(1)计算所需KCl的质量
需要KCl的质量为
(2)称量 固体 称量过程中主要用到的仪器是
(3)将KCl加入100mL烧杯中,加适量蒸馏水溶解 为加快溶解,可采取的措施是
(4)将烧杯中的溶液转移至500mL容量瓶中 为防止溶液溅出,应该采取的措施是
(5)向容量瓶中加蒸馏水至刻度线 在进行此操作时应注意的问题是
你认为按上述步骤配制的KCl溶液的浓度是否为0.200mol•L﹣1,请说明理由. .
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)高炉炼铁中起还原作用的物质是CO,该物质与氧化铁发生反应的化学方程式是
(2)FeCl2溶液中加入氢氧化钠溶液,反应的现象是 ,所涉及的化学方程式有:
(3)写出下列反应的离子方程式
硫酸与氢氧化钡:
碳酸氢钠与盐酸:
碳酸氢钠与氢氧化钠: .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com