
【题目】钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢铁占世界钢铁年产量的四分之一。钢铁容易生锈的主要原因是因为钢铁在炼制过程中混有少量的碳杂质,在潮湿的空气中容易形成原电池,发生电化学腐蚀。
(1)在空气酸度不大的环境中,其正极反应式为___________________
(2)下列各情况,在其中Fe片腐蚀由快到慢的顺序是___________(用序号表示)。

(3)下图装罝的盐桥中盛有饱和NH4NO3琼脂溶液,能够连接两份电解质溶液,形成闭合回路:

①该装置的能量转化形式为:_________,装置工作时,盐桥中的NH4+移向___________。(“CuSO4溶液”或“AgNO3溶液”)
②若将盐桥换成铜丝,电路中也有电流通过,则铜丝左端为_________极,该极反应式为:___________。
(4)运用原电池原理,设计实验验证Cu2+、Fe3+氧化性的强弱,在下图方框内画出实验装置图_____________(要求:设计一个带盐桥的原电池,标出电极名称及电解质溶液)。该原电池正极反应式__________________。
【答案】 O2+ 2H2O+4e- = 4OH- (5) >(2)>(1)>(3)>(4) 化学能转化为电能 AgNO3溶液 阴 Cu2++2e-=Cu Fe3++e-=Fe2+ 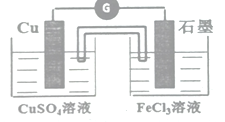
【解析】(1)钢铁在空气酸度不大的环境中,形成原电池发生吸氧腐蚀,正极碳上氧气得电子发生还原反应,电极反应式为:O2+ 2H2O+4e- = 4OH-。
(2)由图知,(1)装置为化学腐蚀;(2)(3)装置是原电池,(2)中,铁作负极,(3)中铁作正极,作负极的腐蚀速率快,正极被保护;(4)(5)装置是电解池,(4)中铁作阴极,(5)中铁作阳极,阳极金属腐蚀速率快,阴极被保护;根据电解原理引起的腐蚀>原电池原理引起的腐蚀>化学腐蚀>原电池原理防护>电解池原理防护,所以Fe片腐蚀由快到慢的顺序是:(5)>(2)>(1)>(3)>(4)。
(3)①该装置存在自发的氧化还原反应:Cu+2Ag+=Cu2++2Ag,可形成原电池,能量转化形式为:化学能转化为电能;Cu作负极,Ag作正极,盐桥中的NH4+向正极方向移动,移向AgNO3溶液。②若将盐桥换成铜丝,则右池为原电池,铜丝右端为负极,Ag为正极,左池为电解池,铜丝左端为阴极,Cu2+得电子发生还原反应,电极反应式为:Cu2++2e-=Cu。
(4)氧化性Fe3+>Cu2+,可发生反应2Fe3++Cu=2Fe2++Cu2+,Cu作还原剂被氧化,可选铜棒作原电池的负极,Fe3+作氧化剂被还原,可选碳棒作正极,实验装置如图所示: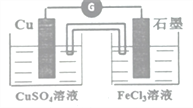 ;Fe3+在正极上得电子被还原,正极反应式为:2Fe3++2e-=2Fe2+。
;Fe3+在正极上得电子被还原,正极反应式为:2Fe3++2e-=2Fe2+。


 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案科目:高中化学 来源: 题型:
【题目】常温下,如果取0.1 mol/LHA溶液与0.1 mol/L NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的PH=8,试回答以下问题:
⑴混合溶液的pH=8的原因(用离子方程式表示):______________________。
⑵混合溶液中由水电离出的c(H+)____0.1mol/L NaOH溶液中由水电离出的c(H+)。(填‘‘>”、“<”或“=”)
(3)求出混合液中下列算式的精确计算结果(填具体数字):c(Na+)-c(A-)=____mol/L,c(H+)+c(HA)=__mol /L。
⑷已知NH4A溶液为中性,又知HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的
pH___7(填“大于”、“小于”或“等于”);将同温度下等浓度的四种盐溶液:
A. NH4HCO3 B.NH4A C. (NH4)2SO4 D. NH4Cl
按pH由大到小的顺序排列是:____________(填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在氯化铝和氯化镁的混合溶液中(此溶液的体积忽略不计),向其中滴加一定体积的C1molL﹣1NaOH溶液之后,改成滴加C2molL﹣1HCl,所得沉淀Y(mol)与试剂(酸和碱)总体积V(mL)间的关系如图所示.则所加入NaOH溶液的体积为mL.[已知:NaOH+Al(OH)3=NaAlO2+2H2O]. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或表示方法不正确的是
A. 等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出的能量少
B. 由H+(aq)+OH-(aq)=H2O(l) △H=-57.3 kJ·mol -1可知,若将含 1 mol CH3COOH的稀溶液与含1 mol NaOH的稀溶液混合,放出的热量大于57.3 kJ
C. 由C(石墨)=C(金刚石)△H=+1.9 kJ·mol -1可知,石墨比金刚石稳定
D. 在100 kPa时,1 g H2完全燃烧生成液态水,放出285. 8 kJ热量,则H2燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l) △H=-571.6 kJ·mol -1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,若电解5 min时,测得铜电极的质量增加21.6 g。试冋答:

(1)电源中Y极是__________极,Cu极为_____________ 极。
(2)电解初始阶段B中总反应的离子方程式为________________。通电5 min时,B中共收集到2. 24L(标准状况)气体,溶液体积为200 mL(电解前后溶液的体积变化忽略不计),则通电前CuSO4溶液的浓度为______。
(3)电解后,A中溶液pH将_________ ( “升高”、“降低”或“不变”)。
(4)若电解后A中仍有Cl-,要使A中溶液恢复至初始状态,需要补充_____________,其质量为_____g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组有机物只用一种试剂无法鉴别的是 ( )
A. 乙醇、甲苯、硝基苯 B. 溴苯、乙酸乙酯、己烯
C. 乙醇、苯、乙酸 D. 苯、四氯化碳、环己烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中有Mg2+、Fe2+和Al3+三种离子,若向其中加入过量的氢氧化钠溶液,微热并搅拌,再加入过量盐酸,溶液中大量减少的阳离子是
A. Al3+B. Mg2+C. Fe2+D. 三种离子都减少
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com