
分析 (1)根据配制0.5mol/L稀硫酸500mL的步骤选择使用的仪器;
(2)根据配制一定物质的量浓度的溶液的步骤对各操作进行排序;
(3)①根据溶液稀释过程中溶质的物质的量不变计算出需要浓硫酸的体积;
②根据所需的浓硫酸的体积为13.6mL,根据大而近的原则来选择量筒;量筒洗涤后直接量取浓硫酸,会导致浓硫酸被稀释;
③浓硫酸稀释过程中放出大量热,通过玻璃棒搅拌可以加速散热过程;有液体溅出,导致配制的溶液中溶质的物质的量偏小,配制溶液浓度偏低;
④根据c=$\frac{n}{V}$并结合溶质的物质的量n和溶液的体积V的变化来进行误差分析.
解答 解:(1)根据配制500mL 0.5mol/L稀硫酸的步骤可知,配制过程中使用的仪器有:量筒、烧杯、玻璃棒、500mL容量瓶、胶头滴管,
故答案为:量筒、烧杯、玻璃棒、500mL容量瓶、胶头滴管;
(2)配制500mL 0.5mol/L稀硫酸的步骤为:计算、量取、稀释、冷却、转移、洗涤、定容、摇匀等,所以正确的操作顺序为:AEFDCB,
故答案为:AEFDCB;
(3)①500mL 0.5mol/L的稀硫酸中含有溶质硫酸的物质的量为:0.5mol/L×0.5L=0.25mol,
设需要98%浓硫酸(密度1.84g/cm3)的浓硫酸的体积为VL:则$\frac{1.84×V×1000×98%}{98}$=0.25,解得V≈0.0136L=13.6mL,
故答案为:13.6;
②由于所需的浓硫酸的体积为13.6mL,根据大而近的原则来选择量筒,则所选的量筒的规格应为15mL;量筒洗涤后直接量取浓硫酸,会导致浓硫酸被稀释,则导致所取的浓硫酸中溶质的量偏小,所配制出的溶液的物质的量浓度偏低,故答案为:15,偏低;
③将浓硫酸沿着烧杯内壁慢慢注入盛水的烧杯中,浓硫酸稀释过程放出大量的热量,需要通过玻璃棒的搅拌使稀释浓硫酸放出的热量迅速散去;若溶液部分溅出,会导致溶质硫酸的物质的量偏低,配制的溶液浓度偏低,
故答案为:使稀释浓硫酸放出的热量迅速散去;偏低.
④浓硫酸稀释放热,故在转入容量瓶前烧杯中液体应冷却至室温,否则定容后溶液体积会偏小,则会使浓度偏高;洗涤烧杯2-3次,洗液也要转入容量瓶,否则会导致溶质的损失,则导致溶液的浓度浓度偏低;定容时俯视会导致溶液体积偏小,则浓度偏高,仰视会使溶液体积偏大,则浓度偏小.
故答案为:冷却至室温;偏高;偏低;偏高;偏低
点评 本题考查了配制一定物质的量浓度的溶液方法,题目难度中等,注意掌握配制一定浓度的溶液步骤及误差分析方法,能够根据配制步骤正确选用仪器.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | PVC保鲜膜属于链状聚合物,在高温时易熔化 | |
| B. | PVC的单体不能由PE的单体与氯化氢加成制得 | |
| C. | 鉴别PE和PVC,可将其放入试管中加热,在试管口放置一湿润的蓝色石蕊试纸,如果试纸变红,则为PVC;不变红,则为PE | |
| D. | 等质量的聚乙烯和乙烯分别完全燃烧,聚乙烯消耗的氧气多 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 ,B的结构式为
,B的结构式为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
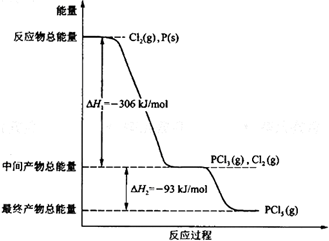 红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图示(图中的△H表示生成1mol产物的数据).
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图示(图中的△H表示生成1mol产物的数据).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图是周期表中短周期的一部分,W、X、Y三种元素原子核外电子数之和等于X的质量数,X原子核内质子数和中子数相等.下列叙述中正确的是( )
如图是周期表中短周期的一部分,W、X、Y三种元素原子核外电子数之和等于X的质量数,X原子核内质子数和中子数相等.下列叙述中正确的是( )| A. | 三种元素的原子半径的大小顺序是W<Y<X | |
| B. | W最高价氧化物对应水化物是强酸,气态氢化物是弱碱 | |
| C. | X元素的氧化物水溶液呈强酸性 | |
| D. | Y元素的单质是非金属单质中唯一能跟水发生剧烈反应的单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题

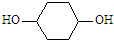 ,写出正确的合成路线:
,写出正确的合成路线: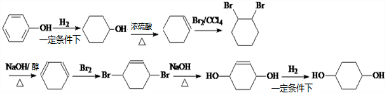 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1 (NH4)2Fe(SO4)2溶液中:K+、Cu2+、Cl-、MnO4- | |
| B. | 0.1 mol•L-1 FeCl2溶液:K+、Na+、SO42-、NO3- | |
| C. | 使甲基橙变红色的溶液:NH4+、Cu2+、ClO-、Cl- | |
| D. | 0.1mol•L-1NaHCO3溶液:K+、AlO2-、Cl-、NO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com