
| A. | 用10mL量筒量取7.13mL稀盐酸 | |
| B. | 用碱式滴定管量取15.20 ml 酸性高锰酸钾溶液 | |
| C. | 配制氯化铁溶液时,把氯化铁溶解在一定浓度的盐酸中,再加水稀释 | |
| D. | 用带有橡胶塞的玻璃试剂瓶盛放NaF溶液 |
分析 A.量筒的感量是0.1mL;
B.碱式滴定管只能量取碱性溶液;
C.氯化铁是强酸弱碱盐,铁离子易水解生成氢氧化铁而使溶液变浑浊,盐酸能抑制氯化铁水解;
D.HF能和二氧化硅反应而腐蚀玻璃.
解答 解:A.量筒的感量是0.1mL,所以用10mL量筒不能量取7.13mL稀盐酸,应该用酸式滴定管量取,故A错误;
B.碱式滴定管只能量取碱性溶液,酸性高锰酸钾溶液呈酸性,应该用酸式滴定管量取,故B错误;
C.氯化铁是强酸弱碱盐,铁离子易水解生成氢氧化铁而使溶液变浑浊,盐酸能抑制氯化铁水解,所以配制氯化铁溶液时,把氯化铁溶解在一定浓度的盐酸中,再加水稀释,故C正确;
D.HF能和二氧化硅反应而腐蚀玻璃,NaF中氟离子水解生成HF而腐蚀玻璃,所以应该用塑料瓶盛放NaF溶液,故D错误;
故选C.
点评 本题考查化学实验方案评价,为高频考点,涉及盐类水解、药品贮存、仪器选取等知识点,明确实验原理、仪器用途、物质性质是解本题关键,注意量筒、滴定管的感量,为易错点.


科目:高中化学 来源: 题型:实验题
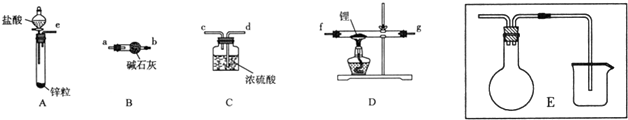
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1Na2CO3溶液:c(Na+)>c(CO${\;}_{3}^{2-}$)>c(HCO${\;}_{3}^{-}$)>c(OH-) | |
| B. | 0.01 mol•L-1CH3COOH溶液,水电离出的c(H+)=10-12mol•L-1 | |
| C. | 0.2 mol•L-1NaClO溶液:c(Na+)═c(ClO-)+c(Cl-)+c(HClO) | |
| D. | pH相同的NH4Cl、(NH4)2SO4溶液:c(NH4Cl)>c[(NH4)2SO4] |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 以上反应均可发生 | B. | 只有⑦不能发生 | ||
| C. | 只有⑥不能发生 | D. | 只有②不能发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
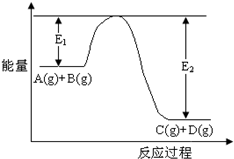
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 雷电使氮气和氧气反应生成了一氧化氮气体 | |
| B. | 一氧化氮与氧气反应生成二氧化氮 | |
| C. | 氨气经催化氧化生成一氧化氮 | |
| D. | 由氨气制碳酸氢氨和硫酸氨 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
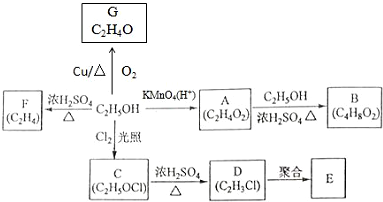
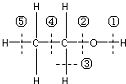
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com