
| A. | Na+、K+、Cl?、NO3? | B. | K+、Na+、ClO?、SO42- | ||
| C. | Al3+、Cu2+、Cl?、S2- | D. | Na+、Fe2+、NO3-、Cl- |
分析 由水电离出的c(H+)=1×10-12 mol•L-1的溶液,为酸或碱溶液,根据离子之间不能结合生成水、气体、沉淀等,不能发生氧化还原反应,则离子能大量共存,以此来解答.
解答 解:由水电离出的c(H+)=1×10-12 mol•L-1的溶液,为酸或碱溶液,
A.无论酸或碱溶液中,该组离子之间均不反应,可大量共存,故A正确;
B.酸性溶液中不能大量存在ClO?,故B错误;
C.碱性条件下Al3+、Cu2+不能大量存在,酸性溶液中不能大量存在S2-,且Al3+、Cu2+、S2-发生互促水解反应,故C错误;
D.酸溶液中Fe2+、Na+、NO3-发生氧化还原反应,碱溶液中不能大量存在Fe2+,不能大量共存,故D错误.
故选A.
点评 本题考查离子的共存,把握离子之间的反应即可解答,为高考常见题型,侧重复分解反应的考查,注意选项D中的氧化还原反应为解答的难点,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | Cu2+、H+、Cl- | B. | K+、CO32-、OH- | C. | Cl-、CO32-、OH- | D. | K+、H+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下的22.4L辛烷完全燃烧,生成二氧化碳分子数为8NA | |
| B. | 20g重水中含有的电子数为10NA | |
| C. | 常温下,5.6g铁与足量的盐酸反应,失去的电子数为0.3NA | |
| D. | 1L 0.1mol/L NH4Cl溶液中含NH4+数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
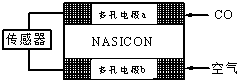
| A. | 负极的电极反应式为:CO+O2--2e-═CO2 | |
| B. | 工作时电极b作正极,O2-由电极a流向电极b | |
| C. | 工作时电子由电极a通过传感器流向电极b | |
| D. | 传感器中通过的电流越大,尾气中CO的含量越高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
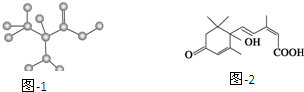
| A. | 苯环上有两个取代基的C9H12,其苯环上一氯代物的同分异构体(不考虑立体异构)共有10种 | |
| B. | 2,2二甲基丙醇与 2甲基丁醇互为同分异构体 | |
| C. | 某只含有C、H、O、N的有机物的简易球棍模型如图1所示,该有机物CH3CH2CH2NO2互为同系物 | |
| D. | S诱抗素的分子结构如图2所示,则该分子的分子式为C15H20O4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KNO3、KClO3与单质S、C2H5OH不能混搭存放在同一库房间 | |
| B. | 缺铁性补血服用补铁剂时,需与维C同时服用 | |
| C. | 铜制品、铁制品在潮湿的空气中生锈 | |
| D. | 用乙醚从黄花蒿中提取青蒿素 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题


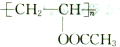 ,D→E的反应类型是取代反应.
,D→E的反应类型是取代反应. .
.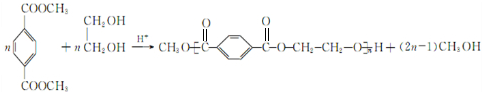 .
.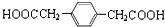 (写结构简式)
(写结构简式)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向上述NaOH溶液中通入SO2:2OH-+SO2═SO32-+H2O | |
| B. | 上述反应后所得溶液的PH约为12:SO32-+H2O?HSO3-+OH- | |
| C. | 向上述反应后所得溶液中通入氯气,PH下降:SO32-+Cl2+2OH-═SO42-+2Cl-+H2O | |
| D. | 向上述反应后所得溶液中滴加少量H2O2和BaCl2溶液的混合液,产生白色沉淀:SO32-+Ba2++H2O2═BaSO4↓+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com