
| A. | 除去蛋白质中的葡萄糖,可以用浓硫酸铵溶液盐析过滤方法提纯 | |
| B. | 双氧水中滴加氯化铁溶液立即产生气泡,说明氯化铁的氧化性比过氧化氢强 | |
| C. | 锂钒氧化物蓄电池放电时电池的总反应式为:V2O5+xLi═LixV2O5.供电时Li+向正极移动,充电时阳极的电极反应式为:LixV2O5-xe-═V2O5+xLi+ | |
| D. | 常温下,Mg(OH)2能溶于氯化铵浓溶液的主要原因是NH4+结合OH-使沉淀溶解平衡发生移动 |
分析 A、盐析是分离和提纯蛋白质;
B、双氧水中滴加氯化铁溶液立即产生气泡,是铁离子对双氧水的分析起催化作用;
C、放电为原电池,充电为电解池,依据电解池阳极发生氧化反应回答;
D、依据盐类水解原理解答.
解答 解:A、除去蛋白质中的葡萄糖,应用盐的方法,可以用浓硫酸铵溶液盐析过滤方法提纯,故A正确;
B、双氧水中滴加氯化铁溶液立即产生气泡,是铁离子对双氧水的分析起催化作用,而不是氧化剂,故B错误;
C、锂钒氧化物蓄电池放电时电池的总反应式为:V2O5+Li=LixV2O5.供电(放电)时Li+向正极移动,正确,充电(电解)时阳极发生失去电子的氧化反应,即阳极的电极反应式为:LixV2O5-xe-=V2O5+xLi+,故C正确;
D、Mg(OH)2能溶于水存在溶解平衡:Mg(OH)2(s)?Mg2+(aq)+2OH-(aq),故加入NH4+结合OH-使沉淀溶解平衡向右移动,故D正确;
故选B.
点评 本题主要考查的是蛋白质的分离与提纯、催化剂的判断、电解原理等,综合性较强,有一定的难度,属于常考题.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | H2(g) | CO2(g) | CH2=CH2 | H2O(g) |
| 能量:KJ/mol | 0 | -394 | 52 | -242 |

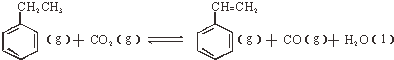 ;△H<0
;△H<0查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,很多不饱和有机物在E催化下可与H2发生加成反应:如①CH2=CH2、②HC≡CH、③
,很多不饱和有机物在E催化下可与H2发生加成反应:如①CH2=CH2、②HC≡CH、③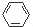 、④HCHO.其中碳原子采取sp2杂化的分子有①③④(填物质序号),HCHO分子的立体结构为平面三角形,它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是(须指明加成产物是何物质)加成产物CH3OH分子之间能形成氢键.
、④HCHO.其中碳原子采取sp2杂化的分子有①③④(填物质序号),HCHO分子的立体结构为平面三角形,它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是(须指明加成产物是何物质)加成产物CH3OH分子之间能形成氢键.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
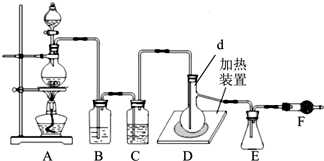
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(A)=1.8 mol•L-1•s-1 | B. | v(B)=0.3 mol•L-1•s-1 | ||
| C. | v(C)=0.6 mol•L-1•s-1 | D. | v(D)=1.6 mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅胶可作食品干燥剂 | B. | 计算机芯片的主要材料是SiO2 | ||
| C. | 糖类物质都属于高分子化合物 | D. | 地沟油和矿物油都属于酯类物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
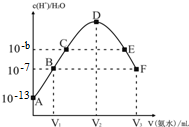
| A. | E溶液中存在:c(NH4+)>c(SO42-)>c(OH-)>c(H+) | |
| B. | 稀硫酸的浓度为0.1mol/L | |
| C. | C点溶液pH=14-b | |
| D. | V2=20 mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com