
分析 (1)根据m(溶质)=m(溶液)×ω计算溶质的质量,计算混合后溶液的质量,利用混合后溶质的质量等于原不同浓度溶液中氯化钠的质量之和计算混合后溶质氢氧化质量分数;
(2)根据c=$\frac{1000ρω}{M}$计算混合液的物质的量浓度.
解答 解:(1)将20.0g14%的NaCl溶液跟30.0g24%的NaCl溶液混合,混合后溶液的质量为20g+30g=50g,
令混合后NaCl的质量分数为ω,则:50g×ω=20g×14%+30g×24%,解得ω=20%,
答:混合后NaCl溶液的质量分数为20%;
(2)混合后溶液中NaCl的物质的量浓度为$\frac{1000×1.15×20%}{58.5}$mol/L=3.93mol/L,
答:混合后氯化钠溶液的物质的量浓度为3.93mol/L.
点评 本题考查物质的量浓度、质量分数的有关计算,难度中等,注意对公式的理解与灵活运用,注意理解掌握物质的量浓度与质量分数之间关系.


科目:高中化学 来源: 题型:解答题
| 时间 | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| c(X)/mol•L-1 | 0.2 | c | 0.6 | 0.6 | 1.0 | c1 | c1 |
| c(Y)/mol•L-1 | 0.6 | c | 0.4 | 0.4 | 0.4 | c2 | c2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
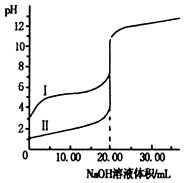 室温下,用0.1mol•L-1 NaOH溶液分别滴定20.00ml0.1mol•L-1的盐酸和醋酸溶液,滴定曲线如图.下列说法正确的是( )
室温下,用0.1mol•L-1 NaOH溶液分别滴定20.00ml0.1mol•L-1的盐酸和醋酸溶液,滴定曲线如图.下列说法正确的是( )| A. | I、Ⅱ分别表示盐酸和醋酸的滴定曲线 | |
| B. | V(NaOH)=10.00mL时,$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$>1 | |
| C. | pH=7时,两种酸所消耗NaOH溶液的体积相等 | |
| D. | V(NaOH)=20.00mL时,c(Cl一)<c(CH3COO一) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应不是氧化还原反应 | B. | 氮气只是氧化产物 | ||
| C. | N2O4是还原剂 | D. | N2O4是氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com