
下列说法正确的是
A.某微粒核外电子排布为2、8、8结构,则该微粒一定是氩原子
B.Na+的半径大于F-的半径
C.F-,Na+,Mg2+,Al3+是与He原子具有相同电子层结构的离子
D.NH4+与H3O+具有相同的质子数和电子数
科目:高中化学 来源:2016届陕西省高三第六次适应性考试理综化学试卷(解析版) 题型:选择题
X、Y、Z、W是短周期主族元素,X原子最外层电子数是次外层的两倍,Y元素在地壳中的含量最多,Z元素的金属性最强,W原子的核外电子数是X原子与Z原子的核外电子数之和。下列叙述正确的是
A.X、Y的氢化物比同族氢化物的沸点均高
B.X、Y、Z形成的化合物不止一种
C.原子半径的大小顺序:r(W)>r(Z)>r(Y)>r(X)
D.Y与Z或W形成的化合物中只含离子键
查看答案和解析>>
科目:高中化学 来源:2016届江西南昌二中、临川一中等高三4月联考二理综化学试卷(解析版) 题型:选择题
短周期元素A、B、C、D最高价氧化物对应水化物分别为W、X、Y、Z,A是短周期中原子半径最大的元素,常温下W、Y、Z均可与X反应,A、C、D的原子序数及0.1 mol/LW、Y、Z溶液的pH如图所示。下列说法正确的是
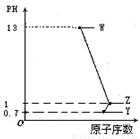
A.B的离子半径大于A的离子半径
B.C氢化物稳定性大于D氢化物稳定性
C.W、Z两物质含有的化学键类型相同
D.B原子的电子层数与最外层电子数相等
查看答案和解析>>
科目:高中化学 来源:2015-2016学年宁夏六盘山高中高一下期中化学试卷(解析版) 题型:选择题
下列各组反应(表中物质均为反应物),反应刚开始时,放出H2的速率最大的是
金属(粉末状)/mol | 酸的浓度及体积 | 反应温度 | |||
A. | Mg | 0.1 | 6mol/L盐酸 | 10mL | 30℃ |
B. | Mg | 0.1 | 3mol/L盐酸 | 10mL | 60℃ |
C. | Fe | 0.1 | 3mol/L盐酸 | 10mL | 60℃ |
D. | Mg | 0.1 | 6mol/L盐酸 | 10mL | 60℃ |
查看答案和解析>>
科目:高中化学 来源:2015-2016学年宁夏六盘山高中高一下期中化学试卷(解析版) 题型:选择题
下列设备工作时,将化学能转化为热能的是
A | B | C | D |
|
|
|
|
硅太阳能电池 | 锂离子电池 | 太阳能集热器 | 燃气灶 |
查看答案和解析>>
科目:高中化学 来源:2016届海南海南中学高三考前模拟十一化学试卷(解析版) 题型:简答题
生活用水的净化、消毒杀菌处理与生产、生活废水的无害化处理与我们的生活密切相关,回答下列问题。
(1)暂时硬度水与永久硬度水煮沸后会出现白色固体的是___________水,除去水垢中CaSO4的试剂是纯碱、盐酸,写出除去CaSO4的离子反应方程式______________________、______________________。
(2)K2FeO4是一种新型的水处理剂,它兼有消毒杀菌、净水双重功能,具有消毒杀菌功能是因为它有___________性。但若水的酸性或碱性较强,该试剂的净水功能均会减弱甚至消失,原因是____________________________________________。
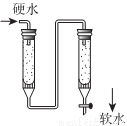
(3)右图是离子交换柱结构示意图,则左侧的是___________(填阴或阳)离子交换柱。硬度为1毅的水是指每升水含10mgCaO或与之相当的物质(如7.1mgMgO)的水。若某天然水中其它离子转化后相当于有c(Ca2+)=1.0×10-3mol/L,此水是否符合我国饮用水的硬度标准为___________(生活用水卫生标准规定,总硬度不超过450mg/L,写出计算式)。
(4)用双硫腙(H2Dz)~CC14络合萃取法可从工业废水中提取金属离子:H2Dz先将金属离子络合成电中性的物质[如Hg(HDz)2等],再用CCl4萃取此络合物。下图是用上述方法处理含有Hg2+、Bi3+、Zn2+的废水时的酸度曲线(E%表示金属离子以络合物形式被萃取分离的百分率)。
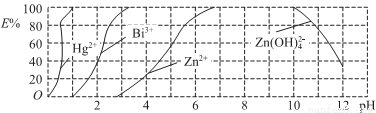
①当废水的pH=4时,废水中能以简单金属离子形式存在的离子是___________。
②当水中n(Bi3+):n[Bi(HDz)3]=3:2时,废水的pH=___________。
③向萃取后的CCl4中加入NaOH溶液可将铋元素以氢氧化物的形式沉淀下来,相应的离子方程式为___________。
查看答案和解析>>
科目:高中化学 来源:2016届海南海南中学高三考前模拟十一化学试卷(解析版) 题型:填空题
锰是重要的过渡元素。
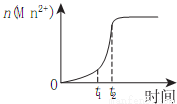
(1)已知常温下KMnO4溶液的pH=7,则0.01mol/LHMnO4溶液的pH=___________;研究表明,一定温度下将酸性KMnO4溶液与草酸溶液混合在一起后,溶液内n(Mn2+)随时间变化的情况如右图,则Mn2+物质的量在t1、t2时段内快速增加的原因可能是___________。
(2)工业上以菱锰矿(MnCO3)[含FeCO3、SiO2、Cu2(OH)2CO3等杂质]为原料制取二氧化锰有多种方法,下面是其中的一种生产流程示意图
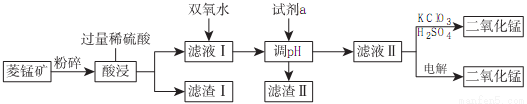
常温下几种金属氢氧化物沉淀时的pH:
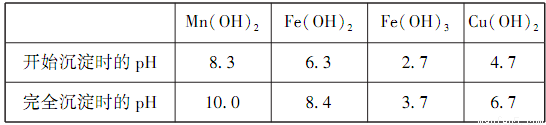
①滤渣Ⅱ的成分是___________,滤液I中反应的离子方程式为___________,
为确保除尽杂质而又不损失锰,pH的调整范围为___________。
②滤液Ⅱ中加入KClO3、H2SO4后反应的化学方程式为___________,用电解法制备MnO2时阳极上的电极反应式为___________。
(3)锰也是制备某些高能原电池的材料,某二次水溶液锂离子电池充电时,总反应方程式为LiMn2O=4Li1-xMn2O4+xLi。若电池的化学能转化为电能时的能量转化率为85%,则当消耗14g锂时,电路中转移的电子数目为___________NA。
查看答案和解析>>
科目:高中化学 来源:2016届陕西省高三第五次适应性考试理综化学试卷(解析版) 题型:填空题
【化学——选修3:物质结构与性质】
卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们。
(1)卤族元素位于周期表的_________区;溴的价电子排布式为_________________。
(2)请根据下表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是_________。
氟 | 氯 | 溴 | 碘 | 铍 | |
第一电离能 (kJ/mol) | 1681 | 1251 | 1140 | 1008 | 900 |
(3)已知高碘酸有两种形式,分别为H5IO6(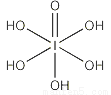 )和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6_____HIO4。(填“>”、 “<”或“=”)
)和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6_____HIO4。(填“>”、 “<”或“=”)
(4)与KI3类似的,还有CsICl2等。已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,则它按下列_____式发生。
A.CsICl2=CsCl+ICl B.CsICl2=CsI+Cl2
(5)已知ClO2-为角型,中心氯原子周围有四对价层电子。ClO2-中心氯原子的杂化轨道类型为___________,与ClO2-互为等电子体的微粒是__________。(任写一个)
(6)右图为碘晶体晶胞结构。有关说法中正确的是_________。
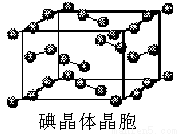
A.碘分子的排列有2种不同的取向,2种取向不同的碘分子以4配位数交替配位形成层结构
B.用均摊法可知平均每个晶胞中有4个碘原子
C.碘晶体为无限延伸的空间结构,是原子晶体
D.碘晶体中的碘原子间存在非极性键和范德华力
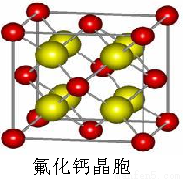
(7) 已知CaF2晶体(见右图)的密度为ρg/cm3,NA为阿伏加德罗常数,相邻的两个Ca2+的核间距为a cm,则CaF2的相对分子质量可以表示为___________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高一下期中化学试卷(解析版) 题型:选择题
下列物质含有的化学键类型完全相同的是( )
A.NaBr和H2O B.Na2O和Na2O2 C.D2O和CO2 D.NH4Cl和HCl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com