
| A. | 放电时,Fe参与负极反应,NiO2参与正极反应 | |
| B. | 充电时,阴极上的电极反应式为:Fe(OH)2+2e-═Fe+2OH- | |
| C. | 蓄电池的电极必须浸入某种碱性电解质溶液中 | |
| D. | 放电时,电解质溶液中的阴离子向正极方向移动 |
分析 根据原电池在放电时,负极发生氧化反应,正极发生还原反应,再根据元素化合价变化,可判断该电池负极发生反应的物质为Fe,正极为NiO2,此电池为碱性电池,在书写电极反应和总电池反应方程式时不能出现H+,故放电时的电极反应是:负极:Fe-2e-+2OH-=Fe(OH)2,正极:NiO2+2e-+2H2O=Ni(OH)2+2OH-.原电池充电时,发生电解反应,此时阴极反应为原电池负极反应的逆反应,阳极反应为原电池正极反应的逆反应.
解答 解:A、放电是原电池,由电池总反应式可知放电时Fe元素的化合价升高,被氧化,应为原电池的负极,NiO2参与正极反应,故A正确;
B、充电是电解池,由方程式可知此电池为碱性电池,反应方程式时不能出现H+,所以充电时阴极和阳极的电极反应式就分别为:Fe(OH)2+2e-=Fe+2OH-、2Ni(OH)2+2OH--2e-=Ni2O3+3H2O,故B正确;
C、由方程式可知此电池为碱性电池,反应方程式时不能出现H+,只能浸在碱性电解质溶液中,故C正确;
D、放电时是原电池,负极:Fe-2e-+2OH-=Fe(OH)2,正极:NiO2+2e-+2H2O=Ni(OH)2+2OH-.电解质溶液中的阴离子向负极方向移动,故D错误;
故选D.
点评 本题考查原电池和电解池知识,题目难度中等,注意把握电极方程式的书写,为解答该题的关键,也是易错点,做题时注意体会.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | v1、v2、K1、K2同时增大 | B. | v1、v2、K1、K2同时减小 | ||
| C. | v1、v2增大,K1增大,K2减小 | D. | v2减小,v1增大,K1增大,K2减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在一定条件下,反应CO(g)+2H2(g)?CH3OH(g)在一密闭容器中达到平衡,充入适量氢气,增大容器的体积,维持H2的浓度和容器的温度不变,原平衡相比较达新平衡时CO的转化率不变 | |
| B. | 常温下:pH=12的NaOH溶液和pH=2的醋酸混合后恰好完全反应(不考虑溶液体积的变化),反应后的溶液中:c(CH3COO-)+c(CH3COOH)=0.01mol/L | |
| C. | pH相同的①CH3COONa;②NaHCO3;③NaAlO2三份溶液中的c(Na+):③>②>① | |
| D. | 已知某温度下:Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=1×10-12,将0.001mol/L的AgNO3溶液逐滴滴入0.001mol/L的KCl和0.001mol/L K2CrO4溶液,则先产生Ag2CrO4沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
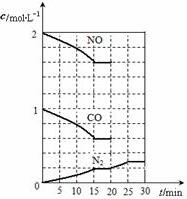 随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.
随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 都正确 | B. | ②③④⑤ | C. | ②⑤⑥ | D. | ④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C>D>B>A | B. | D>B>A>C | C. | A>D>C>B | D. | B>A>C>D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤和石油都是混合物,都只由碳和氢两种元素组成 | |
| B. | 煤的气化和液化都是物理变化 | |
| C. | 煤的干馏和石油的分馏发生的都是化学变化 | |
| D. | 用溴的四氯化碳溶液可鉴别直馏汽油和裂化汽油 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com