
分析 (1)依据热化学方程式和盖斯定律计算①+②+③得到CO2与NH3合成尿素和液态水的热化学反应方程式;
(2)合成氨反应为:N2+3H2?2NH3,测得合成塔入口处气体N2、H2、NH3的体积比为6:18:1,设这三种气体体积分别为6xL、18xL、xL,设H2的转化率为a,则参加反应的氢气体积为18xaL,出口处N2、H2、NH3的体积分别为6x(1-a)L、(18x-18xa)L、(x+6xa)L,出口处N2、H2、NH3的体积比为9:27:8,即6x(1-a)L:(18x-18xa)L:(x+6xa)L=9:27:8,据此计算氢气转化率;
(3)在厌氧氨氧化菌的催化作用下,使铵盐与亚硝酸盐反应生成N2和水;
(4)N2/H2生物燃料电池,以质子交换膜为隔膜,室温条件下合成了氨的同时还提供了电能,是发生原电池反应,负极是氢气失电子发生氧化反应,正极是氮气得到电子发生还原反应;
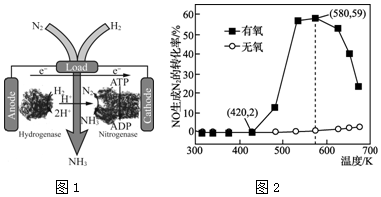
(5)在有氧条件下,温度580K之后NO生成N2的转化率降低,是催化剂活性减小,在温度为420~580K时,有氧条件下NO生成N2的转化率明显高于无氧条件,是一氧化氮和氧气易发生反应生成二氧化氮,二氧化氮与氨气更易发生氧化还原反应.
解答 解:(1)①2NH3(g)+CO2(g)═NH2CO2NH4(s)△H=-159.5kJ•mol-1
②NH2CO2NH4(s)═CO(NH2)2(s)+H2O(l)△H=+28.5kJ•mol-1
③H2O(l)═H2O(g)△H=+44.0kJ•mol-1
盖斯定律计算①+②+③,则NH3(g)与CO2(g)合成CO(NH2)2(s)和H2O(g)的热化学方程式为2NH3(g)+CO2(g)═CO(NH2)2(s)+H2O(g)△H=-87 kJ•mol-1 ,
故答案为:2NH3(g)+CO2(g)═CO(NH2)2(s)+H2O(g)△H=-87 kJ•mol-1;
(2)合成氨反应为:N2+3H2?2NH3,测得合成塔入口处气体N2、H2、NH3的体积比为6:18:1,设这三种气体体积分别为6xL、18xL、xL,设H2的转化率为a,则参加反应的氢气体积为18xaL,出口处N2、H2、NH3的体积分别为6x(1-a)L、(18x-18xa)L、(x+12xa)L,出口处N2、H2、NH3的体积比为9:27:8,即6x(1-a)L:(18x-18xa)L:(x+12xa)L=9:27:8,则氢气转化率a为25%,
故答案为:25%;
(3)在厌氧氨氧化菌的催化作用下,使铵盐与亚硝酸盐反应生成N2和水,反应的离子方程式为:NH4++NO2-$\frac{\underline{\;厌氧氨氧化菌\;}}{\;}$N2+2H2O,
故答案为:NH4++NO2-$\frac{\underline{\;厌氧氨氧化菌\;}}{\;}$N2+2H2O;
(4)N2/H2生物燃料电池,以质子交换膜为隔膜,室温条件下合成了氨的同时还提供了电能,是发生原电池反应,负极是氢气失电子发生氧化反应,正极是氮气得到电子发生还原反应,正极电极反应N2+6e-+6H+═2NH3,
故答案为:N2+6e-+6H+═2NH3;
(5)在有氧条件下,温度580K之后NO生成N2的转化率降低的原因可能是催化剂活性降低,在温度为420~580K时,有氧条件下NO生成N2的转化率明显高于无氧条件的原因可能是:NO与O2反应生成NO2,NO2更易与NH3反应,
故答案为:催化剂活性降低;NO与O2反应生成NO2,NO2更易与NH3反应.
点评 本题考查了热化学方程式书写、化学平衡计算、原电池原理分析、图象变化趋势的理解应用,掌握基础是解题关键,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 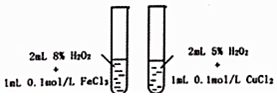 探究不同催化剂对H2O分解速率影响 | |
| B. | 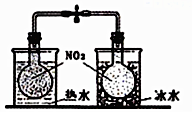 探究温度对2NO2?N2O2平衡影响 | |
| C. |  验证Cr2O72-+H2O?2CrO42-+H+平衡状态变化 | |
| D. |  验证钠和水反应的热效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
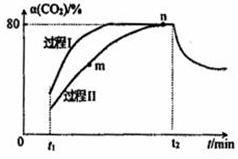 一定条件下,CO2(g)+3H2(g)?H2O(g)+CH3OH(g)△H=-53.7kJ/mol;向2L 恒容恒温密闭容器中充入1mol CO2和2.8molH2反应,图中过程I、Ⅱ是在两种不同催化剂作用下建立平衡的过程中CO2的转化率[α(CO2)]随时间(t)的变化曲线.下列说法不正确的是( )
一定条件下,CO2(g)+3H2(g)?H2O(g)+CH3OH(g)△H=-53.7kJ/mol;向2L 恒容恒温密闭容器中充入1mol CO2和2.8molH2反应,图中过程I、Ⅱ是在两种不同催化剂作用下建立平衡的过程中CO2的转化率[α(CO2)]随时间(t)的变化曲线.下列说法不正确的是( )| A. | m点:v(正)>v(逆) | |
| B. | 活化能:过程Ⅱ>过程I | |
| C. | n点时该反应的平衡常数K=50 | |
| D. | 过程I,t2时刻改变的反应条件可能是升高温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铜和稀硝酸反应时,会出现奇妙的速率变化,开始时二者的反应速率非常慢,但随着反应的进行,反应速率却逐渐明显加快.对于上述变化的原因,课外活动小组同学进行了实验探究.
铜和稀硝酸反应时,会出现奇妙的速率变化,开始时二者的反应速率非常慢,但随着反应的进行,反应速率却逐渐明显加快.对于上述变化的原因,课外活动小组同学进行了实验探究.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
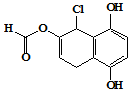
| A. | 不能发生银镜发应,能发生水解反应 | |
| B. | 1mol 该物质最多可与含2mol溴单质的浓溴水反应 | |
| C. | 1mol 该物质最多可与4molNaOH反应 | |
| D. | 与Na、NaHCO3、Na2CO3均能发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径:W>Z>X | |
| B. | 单质熔点:W>Z | |
| C. | 最高正价:W>X>Y>Z | |
| D. | W、X、Z最高价氧化物对应的水化物相互之间能发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 用装置甲制取氯气 | |
| B. | 用装置乙使Br-全部转化为溴单质 | |
| C. | 用装置丙分液时先从下口放出水层,再从上口倒出有机层 | |
| D. | 用装置丁将分液后的水层蒸发至干,再灼烧制得无水FeCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,pH=2的硫酸溶液中,由水电离出的H+个数为10-12NA | |
| B. | 标准状况下,1.12L二氯甲烷含氯离子数为0.2NA | |
| C. | 向过量FeI2溶液中通入Cl2,当有1mol Fe2+被氧化时,转移的电子数为3NA | |
| D. | 2molNH3与3molO2在催化剂作用下加热充分反应后,所得NO分子数小于2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验要求 | 化学试剂 |
| (1)检验酒精中是否有水 | ④ |
| (2)吸收CO中的H2O | ② |
| (3)验证味精中是否有食盐 | ① |
| (4)分离碘水中的碘 | ③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com