
| 选项 | 陈述Ⅰ | 陈述Ⅱ | 判断 |
| A | Na2CO3可与盐酸反应 | 碳酸钠溶液可用于治疗胃酸过多 | Ⅰ对,Ⅱ对,有 |
| B | Cl2使鲜艳的红色花瓣褪色 | Cl2具有漂白性 | Ⅰ对,Ⅱ对,有 |
| C | 铝制饮具最好不要盛放酸性或碱性 较强的液体食物 | 因为Al和Al2O3既可以与酸反应, 又可以与碱反应 | Ⅰ对,Ⅱ对,无 |
| D | Na2O2能和CO2、H2O反应生成O2 | 过氧化钠可用作航天员的供氧剂 | Ⅰ对,Ⅱ对,有 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.治疗胃酸过多要用NaHCO3而不是Na2CO3;
B.氯气不具有漂白性;
C.Al和Al2O3既可以与酸反应、又可以与碱反应;
D.发生氧化还原反应均生成氧气.
解答 解:A.治疗胃酸过多要用NaHCO3而不是Na2CO3,碳酸钠的碱性较强,不能用来中和胃酸,故A错误;
B.氯气不具有漂白性,氯气与水反应生成的HClO具有漂白性,故B错误;
C.Al可与酸或碱反应生成氢气,Al2O3为两性氧化物,既可以与酸反应、又可以与碱反应,有联系,故C错误;
D.发生氧化还原反应均生成氧气,可作供氧剂,陈述和因果关系均合理,故D正确.
故选D.
点评 本题考查化学实验方案的评价,涉及化学反应、漂白性、物质的性质与用途等,侧重物质性质的考查,注重基础知识的训练,题目难度不大.


 一线名师提优试卷系列答案
一线名师提优试卷系列答案科目:高中化学 来源: 题型:选择题
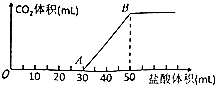 将5.04gNa2CO3、NaOH的固体混合物加水溶解,向该溶液中逐滴加入2mol•L-1的盐酸,所加盐酸的体积与产生CO2的体积(标准状况)关系如图所示,下列说法中不正确的是( )
将5.04gNa2CO3、NaOH的固体混合物加水溶解,向该溶液中逐滴加入2mol•L-1的盐酸,所加盐酸的体积与产生CO2的体积(标准状况)关系如图所示,下列说法中不正确的是( )| A. | OA段发生反应的离子方程式为:H++OH-═H2O CO32-+H+═HCO3- | |
| B. | B点溶液中的溶质为NaCl,其质量为5.85g | |
| C. | 当加入35mL盐酸时,产生CO2的体积为224mL(标准状况) | |
| D. | 混合物中NaOH的质量2.40g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
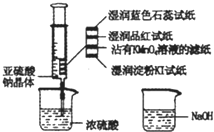 如图,在注射器中加人少量Na2SO3晶体,并吸人少f浓硫酸(以不接触纸条为准).则下列有关说法正确的是( )
如图,在注射器中加人少量Na2SO3晶体,并吸人少f浓硫酸(以不接触纸条为准).则下列有关说法正确的是( )| A. | 湿润淀粉碘化钾试纸未变蓝说明SO2不能将I-还 原为I2 | |
| B. | 品红试纸、沾有KMnO4溶液的滤纸均褪色证明了SO2具有漂白性 | |
| C. | 实验后,可把注射器中的物质推人NaOH溶液,以减少环境污染 | |
| D. | 蓝色石蕊试纸先变红后褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在滴加酸碱指示剂酚酞试液后呈现红色的溶液中:Na+、Cl-、AlO2-、CO32- | |
| B. | 在由水电离出的c(H+)=1×10-12mol/L的溶液中:HCO3-、Al3+、NH4+、ClO- | |
| C. | 在$\frac{c({H}^{+})}{c(0{H}^{-})}$=1×1012的溶液中:Fe2+、Mg2+、CO32-、NO3- | |
| D. | 在AlCl3溶液中:K+、NO3-、S2-、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
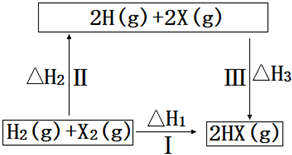
| A. | 2H(g)+2X(g)=2HX(g)△H3<0 | |
| B. | 途径Ⅰ生成HX的反应热与途径无关,所以△H1=△H2+△H3 | |
| C. | 途径Ⅰ生成HBr放出的热量比生成HCl的少,说明HBr比HCl稳定 | |
| D. | Cl、Br、I的非金属性依次减弱,所以途径Ⅱ吸收的热量依次减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
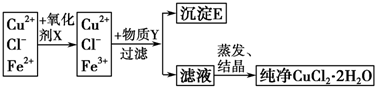
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性溶液中只存在H+,不存在0H-,只有中性溶液或纯水中既有H+又有OH- | |
| B. | 温度越高,KW越大,所以温度高的溶液中的c(H+)一定比温度低的溶液中的c(H+)大 | |
| C. | 水的电离平衡受酸、碱和温度等条件的影响 | |
| D. | 向水中加人碱时,由于加人的OH-与水电离产生的H+作用.使c(H+)减小,平衡向电离的方向移动. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com